Tamoxifen Biverkningar
-
Rea!Det ursprungliga priset var: 767,00 kr.442,00 krDet nuvarande priset är: 442,00 kr.
Anastrozol (Kyaresta) (1 mg x 28 Tabletter)
Det ursprungliga priset var: 767,00 kr.442,00 krDet nuvarande priset är: 442,00 kr. Lägg till i varukorgQuick View -
715,00 kr
Ämne: Anastrozole (Arimidex)
Varumärke: Teva
Paket: 28 Tabletter x 1mg
Anastrozole (Teva) (28 Tabletter x 1mg)
715,00 kr Lägg till i varukorgQuick View -
403,00 kr
Substans: Cabergolin
Märke: Elbrus Pharmaceuticals
Dosering: 20 Tabletter x 0.5mg


Cabergolin (Caber) (Elbrus Pharma) (20 Tabletter x 0.5mg)
403,00 kr Lägg till i varukorgQuick View -
403,00 kr
Ämne: Cabergoline (Dostinex)
Varumärke: Ingenus Pharma
Paket: 8 Tabletter x 0.5 mg
Cabergoline (Ingenus Pharma) (8 Tabletter x 0.5 mg)
403,00 kr Lägg till i varukorgQuick View -

Choriomon (IBSA) (5000 IU)
585,00 kr Lägg till i varukorgQuick View -
403,00 kr
Substans: Clomiphene Citrate
Märke: Elbrus Pharmaceuticals
Dosering: 40 Tabletter x 50mg
Clomiphene (Clomid) (Elbrus Pharma) (40 Tabletter x 50mg)
403,00 kr Lägg till i varukorgQuick View -
715,00 kr
Ämne: Human Chorionic Gonadotropin (HCG)
Varumärke: Avex Pharma
Paket: 5000IU + BA

HCG (Avex Pharma) (5000IU)
715,00 kr Lägg till i varukorgQuick View -
520,00 kr
Ämne:
Clomiphene 25mg
Yohimbine Extract 98%:10 mg
Vitamin E 50mg
Zinc Glycine 15mg
Maca Root (10:1) Extract 75 mg
Silybum marianum extract 98% 75 mg
Varumärke: Elbrus Pharma
Paket: 60 Kapslar x 250 mg

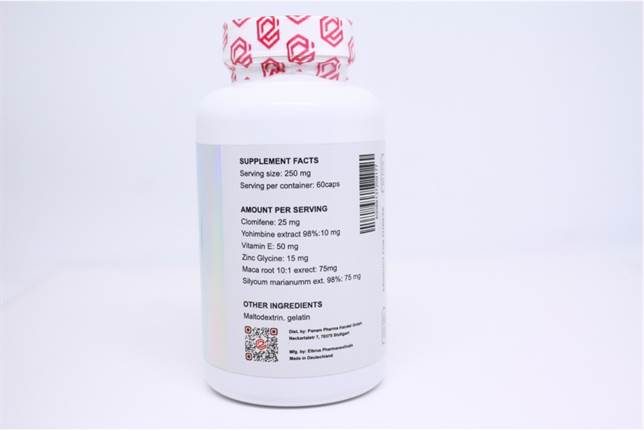
PCT (Elbrus Pharma) (60 Kapslar x 250 mg)
520,00 kr Lägg till i varukorgQuick View -
299,00 kr
Ämne: Tamoxifen
Varumärke: Genepharm
Paket: 30 Tabletter x 20 mg
Tamoxifen (Zymoplex) (30 Tabletter x 20 mg)
299,00 kr Lägg till i varukorgQuick View -
1.365,00 kr
Substans: Anastrozole
Tillverkare: Astra Zeneca
Dosering: 28 Tabletter x 1mg
Slutsåld!
 Sold out!
Sold out!
Arimidex (Astra Zeneca) (28 Tabletter x 1mg)
1.365,00 kr Läs merQuick View -
312,00 kr
Substans: Clomiphene Citrate
Tillverkare: Anfarm Hellas
Dosering: 24 Tabletter x 50mg
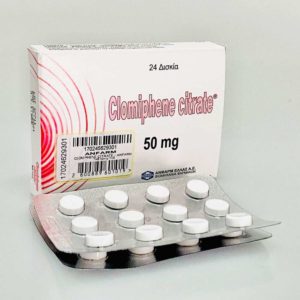
Clomiphene Citrate (Anfarm Hellas) (24 Tabletter x 50mg)
312,00 kr Lägg till i varukorgQuick View -
1.352,00 kr
Substans: Clomiphene, Tamoxifen, Tadafinil
Tillverkare: iMuscle
Dosering: Clomi – 20 / 20mg, Nolva – 10 / 10mg, Ci – 10 / 10mg (60 Kapslar )

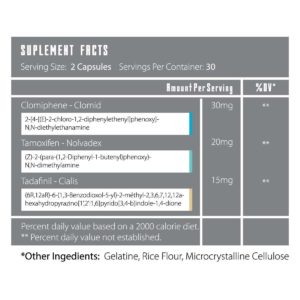
PCT-XXL iMuscle (Clomiphene+Tamoxifen+Tadafinil) (60 Kapslar ) (Sarms)
1.352,00 kr Lägg till i varukorgQuick View
Toxicitetsöversikt:
IDENTIFIKATION: Tamoxifen är ett anti-östrogent icke-steroidalt läkemedel.
Indikationer: Behandling av avancerad bröstcancer och adjuvant behandling av tidig bröstcancer.
Behandling av anovulatorisk infertilitet.
Mänskligt exponering: Huvudrisker och målorgan: Biverkningar vid terapeutisk användning är vanligtvis lindriga.
De inkluderar effekter som orsakas av antagonism av endogena östrogener: värmevallningar, ospecifika gastrointestinala effekter (illamående och kräkningar), effekter i centrala nervsystemet och sällsynta okulära effekter.
Negativa hematologiska effekter har rapporterats, även isolerade fall av död från peliosis hepatis och från hyperlipidemi.
Vid behandling av bröstcancer kan hyperkalcemi och tumörutbländning uppstå.
Sammanfattning av kliniska effekter: Anti-östrogena effekter hos kvinnor som behandlats med tamoxifen inkluderar vasomotoriska symtom (värmevallningar), vaginal blödning och (hos premenopausala kvinnor) oregelbundna menstruationer och pruritus vulvae.
Illamående och kräkningar kan förekomma.
Yrsel, slöhet, depression, irritabilitet och dysfunktion i hjärnan har beskrivits.
Reversibel retinopati med makulärt ödem har rapporterats efter höga kumulativa doser och hornhinneförändringar kan inträffa.
Trombocytopeni eller leukopeni har associerats med tamoxifenbehandling.
Tromboembolism, som kan bero på sjukdomen snarare än behandlingen, har registrerats hos kvinnor som fick tamoxifen för bröstcancer.
Kontraindikationer: Graviditet är en absolut kontraindikation på grund av de anti-östrogena effekterna.
Inträdesvägar: Oral: Vanlig inträdesväg Absorption per exponeringsväg: Toppkoncentrationer inträffar 4-7 timmar efter oral dosering.
Toppkoncentrationerna efter en enda oral dos är cirka 40 u / l.
Distribution per exponeringsväg: Tamoxifen är mer än 99% proteinbundet i serum, främst till albumin.
15 citat från Arnold Schwarzenegger
Hos patienter med bröstcancer är koncentrationen av tamoxifen och dess metaboliter i pleural, perikardiell och peritoneal effusionsvätska mellan 20 och 100% av de i serum, men endast spårmängder kommer in i cerebrospinalvätskan.
Koncentrationerna i bröstcancervävnad överstiger de i serum.
Distributionsvolymen är 50-60 l / kg.
Biologisk halveringstid per exponeringsväg: Elimineringen är bifasisk, med en initial halveringstid på cirka 7 timmar och en terminal halveringstid på 7-11 dagar.
Ämnesomsättning: Tamoxifen citrat N-desmetyl-tamoxifen, 4-hydroxitamoxifen, 4-hydroxi-N-desmetyl-tamoxifen och N-desdimetyl-tamoxifen. Eliminering genom exponeringsväg: Den viktigaste utsöndringsvägen är via gallan när metaboliter och enterohepatisk recirkulation sker.
Mindre än 1% utsöndras i urinen.
Åtgärdssätt: Toxikodynamik: De negativa effekterna som observeras beror främst på dess anti-östrogeneffekt, eftersom Tamoxifen och vissa av dess metaboliter motverkar effekterna av östrogener i östrogenkänsliga vävnader.
Farmakodynamik: Tamoxifen och flera av dess metaboliter (i synnerhet 4-hydroxytamoxifen) binder till nukleära östrogenreceptorer i östrogenkänsliga vävnader, och även till ett mikrosomalt protein som kallas antiöstrogenbindningsstället.
Tamoxifen stör den fysiologiska sekvensen genom vilken östrogen binds till dess receptor, translokeras i kärnan och aktiverar sedan messenger-RNA-syntes.
Även om tamoxifenreceptorkomplexet transporteras i kärnan på samma sätt som östrogenreceptorkomplex misslyckas det att aktivera syntes av mRNA.
Karcinogenicitet: En fallkontrollstudie visade en signifikant ökad relativ risk för carcinom i livmodern hos kvinnor som tidigare behandlats med tamoxifen och som tidigare haft strålbehandling med livmodern.
Studien visade en ökning av den relativa risken med enbart tamoxifen-behandling som inte var statistiskt signifikant.
Teratogenicitet: Studier på neonatala manliga och kvinnliga möss i relativa doser som är tio gånger högre än de som används hos människor har visat onormala könsorganskanaler.
Interaktioner: Tamoxifen förstärker den antikoagulantiska effekten av warfarin, och denna interaktion kan vara livshotande.
Huvudsakliga biverkningar: Biverkningarna är vanligtvis milda.
Trombocytopeni, leukopeni, tromboembolism, peliosis hepatis och hyperlipidemi har nämnts i fallrapporter.
Svår hyperkalcemi kan sällan uppstå när behandling påbörjas hos patienter med benmetastaser.
Kronisk förgiftning: Förtäring: Retinalskada och keratit har rapporterats hos patienter efter stora kumulativa doser av tamoxifen i mer än 1 år, men ibland med mindre doser.
Det verkar finnas samband mellan långvarig administration av tamoxifen och proliferation av endometri.
Neurologisk: CNS: Ett fall av depression, synkope och inkoordination har beskrivits under terapi med 10 mg två gånger dagligen.
Symtomen försvann när tamoxifen avbröts och uppträdde igen när behandlingen startades om.
Gastrointestinal: Illamående och kräkningar uppträder med terapeutiska doser hos vissa patienter och förväntas i överdosering.
Lever: Ett dödligt fall av peliosis hepatis har rapporterats hos en kvinna som behandlats med tamoxifen i 2 år efter mastektomi för karcinom.
Urin: Annat: Ett fall av ihållande nattlig priapism har rapporterats.
Endokrina och reproduktiva system: De anti-östrogena effekterna av tamoxifen hos premenopausala kvinnor som får terapeutiska doser kan orsaka oregelbundna menstruationer.
Anti-östrogena biverkningar hos kvinnor som behandlas med tamoxifen inkluderar vasomotoriska symtom och vaginal blödning och pruritus vulvae.
Ögon, öron, näsa, hals: lokala effekter: Behandling har förknippats med förändringar i näthinnan och hornhinnan.
Hematologisk: Tromboembolism kan vara vanligare hos patienter som behandlas med tamoxifen, men detta är inte säkert, eftersom patienter med cancer är i ökad risk ändå.
En liten minskning av antitrombin III-koncentrationen noterades i en studie av 11 postmenopausala kvinnor behandlade med tamoxifen, men den var kliniskt obetydlig och ingen signifikant reduktion sågs hos en grupp av premenopausala kvinnor.
Trombocytopeni och leukopeni kan uppstå under terapi, men är vanligtvis inte allvarliga.
Ett fall av allvarligt myelosuppression har rapporterats.
Vätske- och elektrolytstörningar: Allvarlig hyperkalcemi, förknippad med ökad benresorption, har noterats när patienter med benmetastaser påbörjade behandlingen.
Andra: Allvarlig hyperlipidemi ses ibland och har tillskrivits en östrogen effekt.
Särskilda risker: Graviditet, amning och enzymbrister.
Djur / växtstudier: Hos vissa djurarter uppvisas östrogena agonisteffekter vid doser motsvarande 10-100 gånger den mänskliga terapeutiska dosen.
Mutagenicitet: Tamoxifen tros inte vara mutagen Tamoxifen citrat
Bevis för cancerframkallande egenskaper:
Hos människor finns det tillräckligt med bevis för tamoxifens cancerframkallande effekt för att öka risken för endometrial cancer och det finns avgörande bevis för att tamoxifen minskar risken för kontralateral bröstcancer hos kvinnor med tidigare diagnos av bröstcancer.
Det finns otillräckliga bevis hos människor för tamoxifens cancerframkallande egenskaper i andra organ.
Det finns tillräckliga bevis i försöksdjur för tamoxifens cancerframkallande egenskaper.
Helhetsbedömning: Tamoxifen är cancerframkallande för människor (grupp 1) och det finns avgörande bevis för att tamoxifen minskar risken för kontralateral bröstcancer
Tamoxifen: känd för att vara en cancerframkallande människa
Mänskliga toxicitetsutdrag:
HUMAN EXPOSURE STUDIES / I en studie för att bestämma den maximala tolererade dosen tamoxifen, förekom akut neurotoxicitet, manifesterad genom tremor, hyperreflexi, ostabil gång och yrsel hos patienter med avancerat (metastaserat) karcinom som fick mycket höga doser av tamoxifen (i .
Dessa biverkningar inträffade inom 3-5 dagar efter inledningen av tamoxifenbehandling och försvann 2-5 dagar efter avslutad läkemedel.
Inga permanenta neurologiska följder rapporterades hos dessa patienter.
Även om ett orsakssamband till tamoxifen inte har fastställts rapporterades anfall hos minst en av dessa patienter flera dagar efter avslutad läkemedel och försvinnande av negativa nervsystemeffekter.
Hos patienter som fick laddningsdoser som överstiger 250 mg / kvm följt av underhållsdoser på 80 mg / kvm administrerade två gånger dagligen rapporterades förlängning av QT-intervallet
SIGNS OCH SYMPTOM / Tunnning och / eller partiell hårförlust förekommer sällan hos patienter som får tamoxifen för metastaserande bröstcancer.
Erythema multiforme, Stevens-Johnsons syndrom och bullous pemfigoid har sällan rapporterats hos patienter som fick tamoxifen.
Hudförändringar har skett hos patienter som fick tamoxifen som adjuvansbehandling för bröstcancer
Tecken och symtom / Allvarliga, livshotande eller dödliga händelser förknippade med tamoxifen används för att minska förekomsten av bröstcancer (i
Det fjärde fallet av heterolog mesodermal tumör i livmoderkroppen, som utvecklades, år efter tamoxifenbehandling för bröstcancer hos en postmenopausal kvinna utan tidigare bäckenbestrålning, presenteras med sammanfallande endometrios och endometrialt intraepitelialt karcinom
Denna fallrapport tjänar till att betona två viktiga funktioner i metastaserat bröstkarcinom.
För det första kan den tamoxifen-inducerade flänsen, även om det är ett sällsynt och självbegränsande fenomen, vara dödligt och måste därför erkännas och behandlas snabbt.
För det andra har de patienter som uppvisar hyperkalcemi, som en del av tamoxifen-inducerad tumörbloss, alltid metastaserad sjukdom, men de kan ha en hållbar prognos om detta är begränsat till skelettet
Hos en kvinnlig patient som hade en kroppsyta på 1.
QT-intervallet inträffade var minst sexfaldigt högre än den maximala rekommenderade dosen
Fyra patienter med livmodersarkom som hade tidigare använt tamoxifenanvändning för tidigare bröstcancer presenteras i denna studie.
Medeltiden för exponering för tamoxifen var 6 (intervall 3-11) år, och den genomsnittliga kumulativa dosen av läkemedlet var 43.
Alla patienter var postmenopausala, och medelåldern var 66 (intervall 61-73) år vid diagnos av malignitet i livmodern.
Två (50%) patienter hade malign uterus-mullerian tumör, och två (50%) hade leiomyosarkom.
Hos en (25%) diagnostiserades patienten med endometrial biopsi för en postmenopausal vaginal blödning.
Alla patienter genomgick operation + eller – adjuvansbehandling (kemoterapi och / eller strålbehandling), och två (50%) patienter dog på grund av sarkom.
Som en följd av detta krävs tidig upptäckt av tamoxifenrelaterat livmodersarkom för ordnad gynekologisk undersökning hos patienter som har tidigare använt tamoxifenanvändning för tidigare bröstcancer
Tamoxifen används alltmer i adjuvant endokrin terapi för patienter med bröstcancer efter kirurgi och vid kemoprevention för högriskpatienter.
Vi presenterar ett fall av bilateral ovariell cystautveckling med på varandra följande unilateral cysta torsion och förhöjd serumöstradiol hos en premenopausal patient som behandlades med tamoxifen efter bröstkonserverande operation
EPIDEMIOLOGY STUDIES / Tamoxifen-behandling av bröstcancer är förknippad med en ökad risk för endometrial cancer, men tamoxifen-relaterade risker för endometrial cancer är oklara hos premenopausala kvinnor, hos långvariga användare av tamoxifen och hos kvinnor för vilka flera år har gått sedan avslutande behandling.
Utredare / genomförde en fallkontrollstudie i Storbritannien för att undersöka dessa risker.
Författarna / jämförde behandlingsinformation om 813 fallpatienter som hade endometriecancer efter deras diagnos för bröstcancer och 1067 kontrollpatienter som hade bröstcancer men inte efterföljande endometriecancer.
Utredare / bedömd risk genom villkorad logistisk regressionsanalys.
Alla statistiska test var dubbelsidiga.
Sammantaget var tamoxifenbehandling, jämfört med ingen behandling, förknippad med en ökad risk för endometrial cancer (oddskvot (OR) = 2).
Som en indikation på bakgrundsnivåerna i behandlingen fick 16% av kontrollpatienterna 5 år eller mer av behandlingen.
Risken för endometrial cancer justerad för behandlingsperiod minskade inte vid uppföljningen till minst 5 år efter det att den sista behandlingen avslutades.
Risken för endometrial cancer var inte associerad med den dagliga dosen av tamoxifen och var jämförbar hos kvinnor före och efter menopaus.
Behandling med tamoxifen förknippades med en mycket större risk för Mullerian och mesodermal blandade endometriala tumörer (OR = 13).
Det finns en ökande risk för endometrial cancer i samband med längre behandling med tamoxifen, som sträcker sig långt över 5 år.
Den ökade risken för endometrial cancer i samband med tamoxifenbehandling bör övervägas kliniskt för både premenopausala och postmenopausala kvinnor under behandlingen och i minst 5 år efter den sista behandlingen
EPIDEMIOLOGY STUDIES / Den totala risken för stroke, speciellt ischemisk stroke, förknippad med tamoxifen-användning / bedömdes / genom att utföra en metaanalys av data rapporterade i bröstcancerstudier.
Den sammanfattade oddsförhållandet (OR) och 95% Cl beräknades med hjälp av Mantel-Haenszel-metoden, följt av ett statistiskt test för heterogenitet.
Nio studier uppfyllde inkluderingskriterierna och sex försök specificerade ischemiska strokeutfall.
Mantel-Haenszel-sammanfattningen ELLER var 1.
Chi2-heterogenitetstestet var 6.
Sammanfattningen av slumpmässiga effekter ELLER för Der Simonian och Laird för varje stroke var 1.
Under en genomsnittlig uppföljningsperiod på 4.
NNH], 313).
Kvinnor med bröstcancer som behandlades med tamoxifen hade 82% ökad risk för ischemisk stroke och 29% ökad risk för stroke, men den absoluta risken är liten
EPIDEMIOLOGY STUDIES / Effekterna av tamoxifenbehandling för bröstcancer på risken för stroke, med beaktande av dos, varaktighet och återkommande användning av tamoxifen och kända riskfaktorer för stroke / bedömdes /.
Författarna / genomförde en kapslad fallkontrollstudie av stroke efter bröstcancer bland kvinnliga invånare i Los Angeles County som deltog i en stor organisation för hälsounderhåll när de diagnostiserades med bröstcancer mellan 1 januari 1980 och 1 juli 2000.
Författarna / erhöll information om bröstcancerbehandling och strokefaktorer genom granskning av journaler och telefonintervjuer.
Föreningen (oddsförhållande [OR] och 95% konfidensintervall [CI]) mellan tamoxifen och stroke risk bestämdes med användning av en villkorad logistisk regressionsmodell, justering för menopausal status och historia av hypertoni och diabetes.
Alla statistiska test var dubbelsidiga.
Av 11 045 kvinnor med bröstcancer, uppfyllde 179 kriterier för strokeberättigande och matchades individuellt till två slagfria kontrollpersoner med bröstcancer vid ålder och år för diagnos av bröstcancer.
Medelåldern vid diagnosen bröstcancer var 66.
SD) = 12.
SD = 4.
Tamoxifen-användning var inte associerad med risken för stroke, varken totalt sett (ELLER = 1).
Kemoterapi, men inte en specifik kemoterapimetod, var förknippad med en ökad risk för stroke, oavsett användning av tamoxifen (ingen användning av tamoxifen, ELLER = 2).
Tamoxifen användning är inte förknippat med ökad stroke risk
EPIDEMIOLOGY STUDIES / En fallkontrollstudie / genomfördes / i Nederländerna för att bedöma effekten av tamoxifen på risken för endometriecancer efter bröstcancer.
Genom det befolkningsbaserade nederländska cancerregistret och två äldre, sjukhusbaserade register, / författarna / identifierade 98 patienter som hade endometriecancer diagnostiserad minst 3 månader efter en diagnos av primär bröstcancer.
Detaljerad information om behandling erhölls för alla dessa patienter och för 285 kontroller, som matchades med fallen för ålder, år för diagnos av bröstcancer och överlevnadstid med intakt livmodern.
Tamoxifen hade använts av 24% av patienterna med efterföljande endometriecancer och 20% av kontrollerna (relativ risk 1.CI 0.
Kvinnor som hade använt tamoxifen i mer än 2 år hade en 2.
Det fanns en signifikant trend med ökande risk för endometriecancer under användning av tamoxifen (p = 0).
Varaktighetssvarstrenderna var liknande med dagliga doser på 40 mg eller 30 mg och mindre.
Dessa resultat stöder hypotesen att användning av tamoxifen ökar risken för endometrial cancer.
Denna östrogena effekt på endometrium var inte relaterad till dosintensiteten.
Läkare bör vara medvetna om den högre risken för endometriecancer hos tamoxifenanvändare
Läkemedelsvarningar:
Fall av tamoxifenassocierad hepatotoxicitet har beskrivits, inklusive kolestas med eller utan cytolys och steatohepatit.
Vi rapporterar fallet av en kvinnlig patient som utvecklade leverändringar under kontinuerlig behandling med tamoxifen
Det har nyligen rapporterats om blödning efter menopaus från endometrial polypper hos kvinnor som fick tamoxifenbehandling mot bröstcancer.
Författarna / beskriver ytterligare fyra patienter som presenterade med vaginal blödning och betonar patologin.
Dessa polypper visade cystiskt utvidgade körtlar i alla fall och stromal decidualisering i två.
Mekanismerna genom vilka tamoxifen kan påverka utvecklingen av dessa polyper diskuteras
Denna fallrapport tjänar till att betona två viktiga funktioner i metastaserat bröstkarcinom.
För det första kan den tamoxifen-inducerade flänsen, även om det är ett sällsynt och självbegränsande fenomen, vara dödligt och måste därför erkännas och behandlas snabbt.
För det andra har de patienter som uppvisar hyperkalcemi, som en del av tamoxifen-inducerad tumörbloss, alltid metastaserad sjukdom, men de kan ha en hållbar prognos om detta är begränsat till skelettet
Det fjärde fallet av heterolog mesodermal tumör i livmoderkroppen, som utvecklades, år efter tamoxifenbehandling för bröstcancer hos en postmenopausal kvinna utan tidigare bäckenbestrålning, presenteras med sammanfallande endometrios och endometrialt intraepitelialt karcinom
Tamoxifen används alltmer i adjuvant endokrin terapi för patienter med bröstcancer efter kirurgi och vid kemoprevention för högriskpatienter.
Vi presenterar ett fall av bilateral ovariell cystautveckling med på varandra följande unilateral cysta torsion och förhöjd serumöstradiol hos en premenopausal patient som behandlades med tamoxifen efter bröstkonserverande operation
Två manliga patienter rapporteras som blev impotenta medan de fick tamoxifen som behandling för bröstcancer.
Testosteronnivåerna vid denna tidpunkt var / liknar / de som hittades efter kastrering och de återkom till det normala efter att tamoxifen togs tillbaka
Fyra patienter med livmodersarkom som hade tidigare använt tamoxifenanvändning för tidigare bröstcancer presenteras i denna studie.
Medeltiden för exponering för tamoxifen var 6 (intervall 3-11) år, och den genomsnittliga kumulativa dosen av läkemedlet var 43.
Alla patienter var postmenopausala, och medelåldern var 66 (intervall 61-73) år vid diagnos av malignitet i livmodern.
Två (50%) patienter hade malign uterus-mullerian tumör, och två (50%) hade leiomyosarkom.
Hos en (25%) diagnostiserades patienten med endometrial biopsi för en postmenopausal vaginal blödning.
Alla patienter genomgick operation + eller – adjuvansbehandling (kemoterapi och / eller strålbehandling), och två (50%) patienter dog på grund av sarkom.
Som en följd av detta krävs tidig upptäckt av tamoxifenrelaterat livmodersarkom för ordnad gynekologisk undersökning hos patienter som har tidigare använt tamoxifenanvändning för tidigare bröstcancer
I en studie för att bestämma den maximala tolererade dosen av tamoxifen inträffade akut neurotoxicitet, manifesterad med tremor, hyperreflexi, ostabil gång och yrsel hos patienter med avancerat (metastaserat) karcinom som fick mycket höga doser av tamoxifen (i.
Dessa biverkningar inträffade inom 3-5 dagar efter inledningen av tamoxifenbehandling och försvann 2-5 dagar efter avslutad läkemedel.
Inga permanenta neurologiska följder rapporterades hos dessa patienter.
Även om ett orsakssamband till tamoxifen inte har fastställts rapporterades anfall hos minst en av dessa patienter flera dagar efter avslutad läkemedel och försvinnande av negativa nervsystemeffekter.
Hos patienter som fick laddningsdoser som överstiger 250 mg / kvm följt av underhållsdoser på 80 mg / kvm administrerade två gånger dagligen rapporterades förlängning av QT-intervallet
I BCPT hade kvinnor utan historia av lungemboli som fick tamoxifen ungefär tre gånger ökat risken för att utveckla en lungemboli (18 mot 6 fall).
Tre kvinnor i studien, som alla fick tamoxifen, dog av lungemboli.
Av fallen med lungemboli inträffade 87% hos kvinnor minst 50 år vid randomiseringen.
BCPT, episoder av lungemboli inträffade i genomsnitt 27 månader (intervall: 2-60 månader) efter inledningen av terapin med läkemedlet
Även om skillnaden inte var signifikant ökade risken för djupvenetrombos (relativ risk för 1.
BCPT (35 mot 22 fall).
En liknande ökning av den relativa risken för djupvenetrombos observerades hos kvinnor i åldern 49 år och yngre som hos kvinnor 50 år eller äldre, även om färre händelser inträffade hos yngre kvinnor.
Kvinnor som hade tromboemboliska händelser riskerade för en andra relaterad händelse (7 av 25 kvinnor som fick placebo och 5 av 48 kvinnor som fick tamoxifen).
Bland kvinnor som fick tamoxifen i BCPT inträffade episoder av djupvenetrombos i genomsnitt 19 månader (intervall: 2-57 månader) efter inledande av terapi med läkemedlet
Trombotiska händelser, inklusive trombos i djupven, lungemboli och ytlig flebit, har också rapporterats hos 1.
Koagulationsfaktorabnormaliteter har observerats vid förlängd tamoxifenbehandling vid vanliga doser, och antitrombin III, fibrinogen och trombocytantal har minskat minimalt
Även om skillnaden inte var signifikant observerades en ökning av förekomsten av stroke vid kvinnor som fick tamoxifen (38 händelser) jämfört med placebo (24 händelser) i BCPT (relativ risk för 1.
Hemorragiska stroke svarade för 10 av 38 (26%) eller 6 av 24 (25%) stroke hos kvinnor som fick tamoxifen respektive placebo.
Tillfälliga stroke svarade för 21 av 38 (55%) eller 14 av 24 (58%) stroke hos kvinnor som fick tamoxifen respektive placebo.
Bland kvinnor som fick tamoxifen eller placebo var 7 av 38 (18%) respektive 4 av 24 (17%) stroke av okänd etiologi.
Dödlig stroke inträffade hos 4 kvinnor som fick tamoxifen och hos 3 kvinnor som fick placebo.
Bland kvinnor som upplevde stroke inträffade 88% hos kvinnor 50 år eller äldre vid randomiseringen.
Bland kvinnor som fick tamoxifen i BCPT inträffade episoder av stroke i genomsnitt 30 månader (intervall: 1-63 månader) efter inledande av terapi med läkemedlet
Vasomotoriska symtom (dvs värmevallningar [blinkar]) förekommer oftare hos patienter som får tamoxifen än hos de som får placebo.
Varmtvätt är en av de vanligaste biverkningarna som rapporteras hos kvinnor som får tamoxifen för behandling eller förebyggande av bröstcancer.
I BCPT inträffade hettopp i 81% av kvinnorna som fick tamoxifen jämfört med 69% av dem som fick placebo.
Dessutom rapporterade fler kvinnor som fick tamoxifen jämfört med placebo varma flöden som var ganska lite eller extremt besvärande (46 mot 29%).
Tillbakadragande från rättegången på grund av heta flödor inträffade oftare bland kvinnor som fick tamoxifen kontra placebo (3
Hyperlipidemier har rapporterats hos patienter som får tamoxifen.
Hypertriglyceridemi har rapporterats hos patienter med bröstcancer som får tamoxifen och kan vara allvarliga, särskilt hos patienter med en känd historia av förhöjda triglyceridnivåer, såsom de som är förknippade med familjär hypertriglyceridemi.
Även om tamoxifen-inducerad hypertriglyceridemi kan reagera på avlägsnande av läkemedlet eller behandling med lipidsänkande medel, såsom fibrater, utvecklade minst en patient fulminant pankreatit och dog därefter.
Periodisk övervakning av plasmakoncentrationen av triglycerider rekommenderas hos patienter med förekommande hyperlipidemier under hela tamoxifenbehandlingen, eftersom hypertriglyceridemi kan komma att försenas
Vätskeansamling har rapporterats hos kvinnor som får tamoxifen som adjuvansbehandling för bröstcancer.
Ödem har också rapporterats hos kvinnor med metastaserad bröstcancer som fick tamoxifen
Vaginal urladdning och menstruations oregelbundenhet förekommer oftare hos patienter som får tamoxifen än hos de som får placebo.
Vaginal urladdning, förekom hos 55%, var en av de vanligaste biverkningarna som rapporterades bland kvinnor som fick tamoxifen för primärt förebyggande av bröstcancer i BCPT.
Dessutom rapporterade fler kvinnor som fick tamoxifen kontra placebo vaginal urladdning som var måttligt, ganska mycket eller extremt besvärande (29 mot 13%).
Tillbakadragande från försöket på grund av vaginal urladdning inträffade oftare bland kvinnor som fick tamoxifen kontra placebo (0.
Vaginal blödning kan uppstå med tamoxifenbehandling.
Vaginal torrhet och pruritus vulvae har rapporterats sällan hos kvinnor som får tamoxifen för metastaserande bröstcancer
En ökad förekomst av endometriförändringar, inklusive hyperplasi och polyper, har associerats med tamoxifen-terapi.
Den underliggande mekanismen för dessa förändringar verkar vara relaterad till östrogena egenskaper hos tamoxifen.
Endometrios och livmoderfibroider, eventuellt till följd av tamoxifens partiella östrogena aktivitet, har sällan rapporterats hos kvinnor som fick tamoxifen.
Dessutom har ovariecyster observerats hos ett litet antal premenopausala patienter med avancerad bröstcancer som har behandlats med tamoxifen.
En ökad förekomst av livmoderfibrer (hos premenopausala och postmenopausala kvinnor) och godartade ovariecyster (hos premenopausala kvinnor) noterades också hos kvinnor som fick tamoxifen i en studie för att förebygga bröstcancer
Förlust av libido och impotens har rapporterats hos vissa manliga patienter och resulterade i att tamoxifenbehandling avbröts.
Hos oligospermiska män som fick tamoxifenbehandling rapporterades ökad lutropin (luteiniserande hormon, LH), follitropin (follikelstimulerande hormon, FSH), testosteron och östrogenkoncentrationer.
Priapism har rapporterats hos minst en patient som fick tamoxifen
Muskuloskeletalsmärta och bensmärta har rapporterats hos patienter med bröstcancer som fick tamoxifen.
Ökad ben- och tumörsmärta eller floss har inträffat med tamoxifen-terapi för metastaserande bröstcancer och är ibland associerade med ett bra tumörrespons.
Patienter med ökad bensmärta kan behöva ytterligare smärtstillande medel.
Patienter med mjukvävnadssjukdom kan uppvisa plötsliga ökningar i storleken på förekommande lesioner, ibland förknippade med markant erytem i och omgivande lesioner, och / eller utveckling av nya lesioner.
Om bensmärta och sjukdomssvängningar uppträder syns de vanligtvis strax efter inledningen av tamoxifenbehandlingen och avtar vanligtvis snabbt.
Hantering av tamoxifen-relaterad flare inkluderar stödjande vård och eventuellt avbrott av behandlingen med läkemedlet, med efterföljande återinförande av terapi i en reducerad dos och gradvis ökning till den vanliga dosen
Hyperkalcemi, i vissa fall livshotande, kan uppstå under initial tamoxifenbehandling hos patienter med metastaserande bröstcancer som har benmetastaser.
Periodisk bestämning av serumkalciumkoncentrationer bör utföras under den första behandlingen hos dessa patienter (t.ex.
Om hyperkalcemi är svår bör läkemedlet avbrytas
Tamoxifen har sällan varit associerad med okulär toxicitet.
Retinopati, hornhinnens opacitet och minskad synskärpa har förekommit hos patienter som fick extremt höga doser av tamoxifen under mer än ett år.
Okulära effekter såsom synstörningar, minskning av färgvisionsuppfattning, hornhinneförändringar, grå starr, behov av gråoperation, optisk neurit, trombos i näthinnan, intraretinala kristaller, posterior subkapsulär opacitet och / eller retinopati har också rapporterats hos patienter som fick rekommenderade doser av drogen.
En något ökad hastighet för att utveckla grå starr och en större risk för att utveckla grå starr och genomgå en grå starr kirurgi observerades hos kvinnor som fick tamoxifen i BCPT
Förändringar i koncentrationen av leverenzym (t.ex.
AST [SGOT] eller ALT [SGPT] -koncentrationer) och ökade bilirubin- och / eller alkaliska fosfatas-koncentrationer har rapporterats hos patienter som fick tamoxifenbehandling.
Sällan har mer allvarliga leveravvikelser, inklusive fettförändringar i levern, kolestas, hepatit, levernekros och död inträffat.
Ett orsakssamband mellan dessa ogynnsamma levereffekter och tamoxifen har inte fastställts
Negativa GI-effekter av tamoxifen, inklusive illamående, anorexi, avsmak för mat och magkramper, har rapporterats hos patienter med bröstcancer
Biverkningar av nervsystemet som rapporterats hos patienter som får tamoxifen för metastaserande bröstcancer inkluderar yrsel, lätthet, huvudvärk, trötthet och mental depression
Trombocytopeni (trombocytantal på 50 000-100 000 cu m och sällan lägre) har ibland inträffat hos patienter som fick tamoxifen för behandling av bröstcancer.
Hemorragiska episoder har sällan inträffat hos patienter med svår trombocytopeni.
Neutropeni, pancytopenia och leukopenia (vita blodkroppar mindre än 3000 / cu m), ibland associerade med anemi och / eller trombocytopeni, har också rapporterats och kan vara allvarliga
Tunnning och / eller partiell förlust av hår förekommer sällan hos patienter som får tamoxifen för metastaserande bröstcancer.
Erythema multiforme, Stevens-Johnsons syndrom och bullous pemfigoid har sällan rapporterats hos patienter som fick tamoxifen.
Hudförändringar har skett hos patienter som fick tamoxifen som adjuvansbehandling för bröstcancer
Allvarliga, livshotande eller dödliga händelser förknippade med tamoxifen som används för att minska förekomsten av bröstcancer (i.
Sjukvårdsleverantörer bör diskutera potentiella fördelar kontra risker med tamoxifenbehandling med kvinnor som överväger användning av läkemedlet för att potentiellt minska risken för att utveckla bröstcancer
På grund av den ökade risken för tromboemboliska händelser förknippade med tamoxifenbehandling i BCPT, är tamoxifen för minskning av förekomsten av bröstcancer kontraindicerat hos kvinnor med en historia av djupvenetrombos eller lungemboli.
Användning av tamoxifen för att minska förekomsten av bröstcancer är också kontraindicerat hos kvinnor som behöver antikoagulantia med ett kumarinderivat.
Kvinnor som får eller som har fått tamoxifen bör omedelbart söka läkare för symptom på oförklarlig andnöd eller svullnad / ömhet i benen
Användning av tamoxifen är förknippat med en ökad förekomst av maligniteter i livmodern.
Kvinnor som får tamoxifen eller kvinnor med en historia av att ha fått tamoxifen som rapporterar onormal vaginal blödning bör utvärderas omgående.
Kvinnor som får eller som har fått tamoxifen bör få rutinmässig gynekologisk vård och bör uppmanas att omedelbart rapportera alla onormala gynekologiska symtom, såsom menstruations oregelbundenheter, onormal vaginal blödning, förändring i vaginal urladdning eller bäcken smärta / tryck till deras läkare
Kvinnor som får eller som har fått tamoxifen bör också kontakta läkare omedelbart efter nya bröstklumpar.
Kvinnor bör informera alla vårdgivare, oavsett orsak till utvärdering, att de får tamoxifenbehandling
Tillverkaren uppger att tamoxifen bör användas med försiktighet hos patienter med leukopeni och trombocytopeni, och periodiska fullständiga blodantal, inklusive trombocytantal, bör utföras hos patienter som får läkemedlet.
Tillverkaren uppger också att periodiska leverfunktionstester bör erhållas
På grund av sällsynta rapporter om lipoproteinavvikelser hos patienter som får tamoxifen, inklusive fall av hypertriglyceridemi, markerad hyperlipoproteinemi, rekommenderas periodisk övervakning av serum triglycerider och kolesterol under tamoxifenbehandling hos patienter med en tidigare existerande hyperlipoproteinemi
Kvinnor som är gravida eller som planerar att bli gravida bör inte använda tamoxifen för att minska risken för bröstcancer
Tamoxifen är kontraindicerat hos patienter med känd överkänslighet mot läkemedlet
I BCPT var 16% av deltagarna i studien 65 år eller äldre och 6% var minst 70 år.
Minskningar i förekomsten av bröstcancer observerades hos kvinnor som fick tamoxifen i alla åldersgrupper.
I alla andra resultat återspeglar resultaten i delmängden av kvinnor 65 år eller äldre de resultat som observerades i delmängden av kvinnor minst 50 år.
I denna studie är risken för allvarliga biverkningar (t.ex.
För sexuellt aktiva kvinnor i fertil ålder som får tamoxifen för att minska förekomsten av bröstcancer bör behandling med läkemedlet initieras under menstruationen.
Hos kvinnor med menstruations oregelbundenhet bör graviditetstestning med negativ beta-HCG bekräftas omedelbart före inledningen av tamoxifenbehandling.
Det är inte känt om tamoxifen fördelas i mjölk.
På grund av potentialen för allvarliga biverkningar av tamoxifen hos ammande barn, bör ett beslut fattas om att avbryta ammande eller läkemedlet, med hänsyn till läkemedlets betydelse för kvinnan.
FDA-graviditetsrisk kategori D: / POSITIV BEVISNING AV RISK.
Studier på människor eller undersöknings- eller postmarknadsföringsdata har visat fosterrisk.
Ändå kan potentiella fördelar med användningen av läkemedlet uppväga den potentiella risken.
Till exempel kan läkemedlet vara acceptabelt om det behövs i en livshotande situation eller allvarlig sjukdom för vilka säkrare läkemedel inte kan användas eller är ineffektiva
Den aktuella studien har prospektivt undersökt förekomsten och förloppet av okulär toxicitet efter lågdos tamoxifenbehandling.
64 patienter med cancer som kunde undersökas analyserades.
Tamoxifen administrerades i en 20 mg daglig dos.
Median behandlingstid var 25 månader.
Median total tamoxifendos var 14.
Fyra patienter hade retinopati och / eller keratopati 10, 27, 31 respektive 35 månader efter initiering av tamoxifen (en förekomst av 6.
Oftalmologiska fynd bestod av minskad synskärpa, bilateralt makulärt ödem, gul-vita prickar i paramacular och fovea-områden hos alla patienter samt korneala opacitet hos en patient.
Efter uttag av tamoxifen visade sig nästan alla okulära avvikelser vara reversibla, med undantag för näthinnens opacitet.
Detta är den första prospektiva studien i litteraturen som indikerar att även konventionell lågdos tamoxifenbehandling kan inducera okulär toxicitet
Författarna / syftet var att undersöka frekvensen av ovariecyster hos tamoxifen-behandlade bröstcancerpatienter.
I studiepopulationen ingick 95 på varandra följande tamoxifenbehandlade premenopausala och postmenopausala kvinnor med bröstcancer som följdes upp av polikliniken vid Hadassah University Hospital mellan september 1990 och juni 1992.
Tamoxifen administrerades oralt (20 mg / dag).
Alla patienter genomgick en bäckenundersökning och vaginal ultrasonografi med en 5 MHz vaginal sond.
Under studien hade 11 av 95 tamoxifen-behandlade bröstcancerpatienter (11%) cyster på äggstockarna.
Fem cystor upptäcktes hos postmenopausala kvinnor (6.
Hos postmenopausala och premenopausala kvinnor var det genomsnittliga behandlingsintervallet för tamoxifen 19.
Hos 8 av de 11 patienterna försvann cystisk äggstocksförstoring efter avslutad behandling med tamoxifen.
Två patienter genomgick laparotomi på grund av ihållande cyster och den tredje på grund av ett snabbt växande myom.
De tre cysterna visade sig vara godartade.
Cystor i äggstockarna är en vanlig biverkning av tamoxifenbehandling.
Cystor i äggstockarna kan utvecklas hos tamoxifen-behandlade premenopausala och postmenopausala kvinnor med bröstcancer.
De flesta av de tamoxifen-associerade cysterna försvinner efter att tamoxifen-behandlingen har övergivits
En patient som fick tamoxifen som adjuvansbehandling för bröstcancer utvecklade mycket allvarlig hypertriglyceridemi, hyperkolesterolemi och akut pankreatit efter att ha behandlats i 4 månader.
Hyperlipidemi korrigerades efter upphörande av tamoxifen och inrättandet av gemfibrozil-behandling.
Denna patient tycks ha typ IV-hyperlipidemi.
Hos sådana patienter föreslås att tamoxifen bör användas med stor försiktighet eftersom den svagt östrogena effekten av detta medel kan orsaka allvarlig och livshotande hyperlipidemi
Kvinnor med bröstcancer som behandlades med tamoxifen hade 82% ökad risk för ischemisk stroke och 29% ökad risk för stroke, men den absoluta risken är liten
Medicinsk övervakning:
Det finns ingen metod tillgänglig för rutinmässig övervakning av personal för bevis på farlig läkemedelseksponering.
Tester för förekomst av mutagener eller kromosomskada är inte läkemedelsspecifika och är endast av värde i kontrollerade studier.
Kemisk analys av urin för närvaro av farliga läkemedel på den känslighetsnivå som krävs för att upptäcka yrkesmässig exponering är begränsad till några få läkemedel och är ännu inte kommersiellt tillgänglig.
Akutmedicinsk behandling:
| Livsuppehållande: |
Denna översikt antar att grundläggande livsstödsåtgärder har införts |
| Kliniska effekter: |
SAMMANFATTNING AV EXPONERING A) ANVÄNDNING: Selektiva östrogenmodulatorer är en klass av föreningar som verkar på östrogenreceptorer för olika användningsområden, inklusive anovulering, hantering av menopausesymtom, preventivmedel, osteoporos, bröstcancer och vaginal atrofi. Dessa läkemedel inkluderar tamoxifen, toremifen och raloxifen. Clomiphene omfattas av en separat ledning. B) FARMAKOLOGI: Dessa föreningar fungerar på östrogenreceptorer med effekter som sträcker sig från full agonister, till blandade agonister / antagonister (agonistiska i vissa vävnader medan antagonistiska i andra) till rena antagonister till alla östrogenreceptorer. Till exempel fungerar tamoxifen som en östrogenreceptorantagonist i bröstet, men som en agonist i livmodern. Däremot uppträder raloxifen som en antagonist i båda vävnaderna. C) TOXIKOLOGI: Toxiska effekter är sekundära till deras effekter på östrogenreceptorer. D) EPIDEMIOLOGI: Överdoser av dessa föreningar är extremt sällsynta. E) MED TERAPEUTISK ANVÄNDNING 1) BIVERKNINGAR: De vanligaste rapporterade biverkningarna vid rekommenderade doser inkluderar värmevallningar, illamående och kräkningar. Trots sällsynta kan tromboemboli uppstå och kan vara livshotande. Andra rapporterade effekter inkluderar leverskada, vanligtvis efter kronisk användning, hyperkalcemi och lokal sjukdomssignal med tillhörande ben- och tumörsmärta. Det har rapporterats om fosterskada och toxicitet med läkemedel från denna klass. Andra potentiella biverkningar inkluderar okulära lesioner, QT-förlängning, neurologiska effekter (tremor, hyperreflexi, ostabil gång, yrsel) depression och gynekologiska maligniteter (livmoderscancer och endometriala cancer). F) MED GIFTIGA / EXPONERING 1) ÖVERDOSERING: Det finns mycket lite information om överdosering av dessa föreningar hos människor. Vid doser 6 gånger (400 mg / m (2) rekommenderade de rekommenderade doserna (20 till 40 mg dagligen), neurotoxicitet (kramper, tremor, hyperreflexi, ostadig gång och yrsel) och EKG-förändringar (förlängd QT-intervall). VITALA TECKN A) Minskad andning kan uppstå efter akut överdos. CARDIOVASCULAR A) Förlängning av QT-intervallet har varit med några av dessa medel. B) Hjärtinfarkt har rapporterats vid kronisk terapeutisk användning. NEUROLOGISK A) Skakning, hyperreflexi, onormal gång, yrsel och eventuellt anfall kan vara resultatet av en akut överdos. B) Depression har associerats med dessa terapeutiska medel. GASTROINTESTINAL A) Illamående och kräkningar är vanliga och kan förväntas efter överdosering. HEPATISK A) Leverenzymnivåer kan vara förhöjda efter överdosering. Andra leverskador har rapporterats, vanligtvis efter kronisk användning. FLUID-ELECTROLYTE A) Hyperkalcemi kan uppstå. HEMATOLOGISK A) Tromboemboliska händelser, inklusive lungemboli, har rapporterats vid kronisk tamoxifen av toremifenbehandling. Trombocytopeni kan uppstå efter en överdos och bör övervakas. MUSKULOSKELETAL A) Lokal sjukdomsfällning, förknippad med ben- och tumörsmärta, har rapporterats. REPRODUKTIVA A) Ospemifen, raloxifen och bazedoxifen / konjugerade östrogener klassificeras som FDA-graviditetskategori X och är kontraindicerade för användning under graviditet. Tamoxifen och toremifene klassificeras som FDA graviditetskategori D. Även om det inte finns några adekvata och välkontrollerade studier på gravida kvinnor, fanns det bevis på fosterskada och toxicitet i vissa fallrapporter och studier av läkemedel i denna klass. Djurstudier har också visat fosterskada och toxicitet. Tamoxifen kan orsaka utvecklingsavvikelser i könsorganen hos människor och ett intervall på många år mellan exponeringen i utero och klinisk manifestation kan förekomma. När toremifen ges till gravida kvinnor kan fosterskada uppstå. Toremifene är embryotoxiskt och fetotoxiskt hos råttor. Dessutom visades läkemedlet att passera placenta och ackumuleras i gnagerfoster. Raloxifene är också kontraindicerat för användning hos ammande mödrar. Toremifen har också visat sig utsöndras i mjölk från mjölkande råttor. I djurstudier visade alla läkemedel i denna klass fertilitet och nedsatt befruktning. CARCINOGENICITY A) En stor, slumpmässig studie indikerade en ökad förekomst av livmodercancer efter 2 till 5 års tamoxifenbehandling. Uppgifter från NSABP B-14-studien visade emellertid ingen ökning i icke-livmoderscancer bland patienter som fick tamoxifen. Baserat på en genomgång av litteraturen antyder data i råttstudier en ökad risk för hepatocellulär cancer. Inga avgörande bevis kopplade emellertid tamoxifen till en ökad risk hos människor. Vid tidpunkten för denna översyn rapporterar tillverkaren inte någon cancerframkallande potential av konjugerade östrogener / bazedoxifen hos människor. I djurstudier observerades en läkemedelsrelaterad ökad förekomst av godartade, ovariella granulosa-celltumörer hos djur som fick bazedoxifen. Läkemedelsrelaterade njuradenom och karcinom noterades också, i närvaro av njurtoxicitet, hos hanråttor |
| Laboratorium: |
A) Övervaka serumelektrolyter och leverenzymer efter en betydande överdos. Specifika läkemedelsnivåer är inte lätt tillgängliga eller särskilt användbara. B) Inställ kontinuerlig hjärtövervakning och erhålla ett EKG |
| Behandlingsöversikt: |
MUNTLIG / PARENTAL EXPONERING A) HANTERING AV MILD FÖR ATT MODERERA TOXICITET 1) Milda till måttliga överdoser kan behandlas symptomatiskt (t.ex. antemetika mot illamående och kräkningar). B) HANTERING AV SVÄRT TOXICITET 1) Allvarlig toxicitet bör behandlas symptomatiskt. Anfall bör behandlas med bensodiazepiner, barbiturater och propofol vid behov. Torsades de pointes kan behandlas med bollar av magnesium och överdrivningstimulering och korrigering av elektrolytavvikelser. Om patienter utvecklar en tromboembolisk händelse, såsom lungemboli, behandlas med andningsstöd och antikoagulering som anges. C) DECONTAMINATION 1) PREHOSPITAL: GI-dekontaminering rekommenderas inte på grund av risken för anfall och efterföljande aspiration. HOSPITAL: Aktivt kol om nyligen, väsentligt intag och patient som kan skydda luftvägar och kooperativ. Det finns inga bevis för flera doser av aktivt kol eller bevattning av hela tarmen. D) ANTIDOTE 1) Ingen specifik motgift finns för denna överdos. E) TORSADES DE POINTES 1) Hemodynamiskt instabila patienter kräver elektrisk kardioversion. Behandla stabila patienter med stimulering av magnesium och / eller förmaksdrift. Korrekt elektrolytavvikelse (hypomagnesemia, hypokalemia, hypocalcemia). MAGNESIUMSULFAT: DOSERING: Vuxen: 2 g IV under 1 till 2 minuter, upprepa 2 g bolus och börja infusion av 0. BARN: 25 till 50 mg / kg utspädd till 10 mg / ml. IV under 5 till 15 min. ÖVERDRIV PACING: Börja med 130 till 150 slag / min, minska som tolererat. Undvik klass Ia (kinidin, disopyramid, prokainamid, aprindin) och de flesta klass III-antidysrytmika (N-acetylprocainamid, sotalol). F) Förstärkt eliminering 1) Det finns inga bevis för användning av dialys, hemoperfusion, urinalkalinisering eller kol med flera doser. Det är osannolikt att hemodialys kommer att gynna patienter eftersom dessa läkemedelsklasser tenderar att vara mycket proteinbundna. G) PATIENTFÖRSLAG 1) HEMKRITERIER: Asymptomatisk med små oavsiktliga exponeringar kan hanteras hemma. OBSERVATIONSKRITERIER: Symtomatiska patienter, de med avsiktligt intag eller oavsiktligt intag av mer än en extra dos ska skickas till vårdinrättningen. ADMISSION KRITERIER: Patienter med ihållande symtom bör läggas in på sjukhuset. KONSULT KRITERIER: Rådfråga en medicinsk toxikolog eller giftcentral för patienter med svår överdos eller i vilken diagnosen är oklar. H) PITFALLS 1) Patienter och leverantörer kan vara medvetna om de potentiella skadliga effekterna av dessa mediciner. Stödjande vård är grundpelaren i akut toxicitet från dessa läkemedel och leverantörer bör koncentrera sig på att behandla symtom och leta efter underliggande orsaker. Var medveten om möjligheten till blandat intag med andra läkemedel som används för cancerterapi. I) FARMAKOKINETIK 1) Dessa läkemedel absorberas i allmänhet oralt. Efter en enda oral dos på 20 mg tamoxifen var tiden för att uppnå maximala plasmakoncentrationer cirka 5 timmar. Distributionsvolymen är mycket stor, med distributionsplatser i hela kroppen inklusive livmoder, endometrium, lever, lunga, bukspottkörtel och hjärna. Dessa mediciner tenderar att vara starkt (95% eller högre) proteinbundna. Distributionens halveringstid är vanligtvis inom timmar (7 till 14 timmar för tamoxifen efter en enda 20 mg dos. Tamoxifen och toremifen har levermetabolism via cytokrom 450-systemet. N-desmetyltamoxifen är den viktigaste metaboliten och har liknande biologisk aktivitet som tamoxifen. En större del av tamoxifen utsöndras via avföringen (65% av dosen under en två veckors period). Det är något mindre eliminering i urinen. J) FÖRBÄTTANDE VILLKOR 1) Betydande läkemedelsinteraktioner inkluderar kumarinantikoagulantia (ökar antikoagulantiaffekter), cytotoxiska medel (ökad risk för tromboemboli) och bromokriptin (kan resultera i ökade tamoxifenivåer). Patienter som är gravida bör undvika dessa mediciner. Dessutom bör dessa läkemedel undvikas hos ammande mödrar eftersom de utsöndras i bröstmjölk. K) DIFFERENTIELL DIAGNOS 1) Differensdiagnosen för dessa patienter är mycket bred, inklusive andra mediciner som kan orsaka liknande symtom som illamående och kräkningar eller andra medicinska orsaker till den stora mängden symtom man kan se från att ta dessa läkemedel eller i överdos |
| Toxicitetsintervall: |
A) TOXICITY: TAMOXIFEN: Doser på 400 mg / m (2) har förknippats med yrsel, tremor, kramper och QT-förlängning. TOREMIFENE: Dosbegränsande illamående, kräkningar och yrsel, samt reversibla hallucinationer och ataxi (en patient) rapporterades hos patienter efter bröstcancer efter menopaus som fick 400 mg / m (2) toremifen. B) TERAPEUTISK DOS: TAMOXIFEN: Vuxen: 20 till 40 mg oralt dagligen. TOREMIFENE: Vuxen: 60 mg oralt en gång dagligen. RALOXIFENE: Vuxen: 60 mg oralt en gång dagligen. PEDIATRIC: Dessa medel är vanligtvis inte indicerade för barn |
Motgift och akutbehandling:
SRP: / Grundläggande behandling: Upprätta en patentluftväg (orofaryngeal eller nasofaryngeal luftväg, om det behövs).
Sug vid behov.
Se upp för tecken på andningsinsufficiens och hjälpa till vid ventilationer om det behövs.
Administrera syre med en nonrebreather-mask vid 10 till 15 l / min.
Monitor för lungödem och behandla vid behov.
Övervaka för chock och behandla vid behov.
Förvänta anfall och behandla vid behov.
Skölj ögonen omedelbart med vatten för ögonkontaminering.
Skölj varje öga kontinuerligt med 0.
NS) under transport.
Använd inte emetik.
För förtäring, skölj munnen och administrera 5 ml / kg upp till 200 ml vatten för utspädning om patienten kan svälja, har en stark gagreflex och inte tappar bort.
Täck hudbrännskador med torra sterila förband efter sanering.
Förgiftningar A och B /
SRP: / Avancerad behandling: Överväg orotrakeal eller nasotrakeal intubation för luftvägskontroll hos patienten som är medvetslös, har svårt lungödem eller är i svår andningsbesvär.
Ventilationstekniker med positivt tryck med en påseventilmaskanordning kan vara fördelaktigt.
Överväg läkemedelsbehandling för lungödem.
Överväg att administrera en beta-agonist såsom albuterol för svår bronkospasm.
Övervaka hjärtrytmen och behandla arytmier vid behov.
Starta IV-administration av D5W / SRP: ”För att hålla öppet”, minimal flödeshastighet /.
Använd 0.
NS) eller ammande ringer om tecken på hypovolemi förekommer.
För hypotoni med tecken på hypovolemi, administrera vätska försiktigt.
Se upp för tecken på vätskebelastning.
Behandla kramper med diazepam eller lorazepam.
Använd proparakainhydroklorid för att hjälpa till att bevattna ögonen.
Toxicitetsöversikt:
IDENTIFIKATION: Tamoxifen är ett anti-östrogent icke-steroidalt läkemedel.
Indikationer: Behandling av avancerad bröstcancer och adjuvant behandling av tidig bröstcancer.
Behandling av anovulatorisk infertilitet.
Mänskligt exponering: Huvudrisker och målorgan: Biverkningar vid terapeutisk användning är vanligtvis lindriga.
De inkluderar effekter som orsakas av antagonism av endogena östrogener: värmevallningar, ospecifika gastrointestinala effekter (illamående och kräkningar), effekter i centrala nervsystemet och sällsynta okulära effekter.
Negativa hematologiska effekter har rapporterats, även isolerade fall av död från peliosis hepatis och från hyperlipidemi.
Vid behandling av bröstcancer kan hyperkalcemi och tumörutbländning uppstå.
Sammanfattning av kliniska effekter: Anti-östrogena effekter hos kvinnor som behandlats med tamoxifen inkluderar vasomotoriska symtom (värmevallningar), vaginal blödning och (hos premenopausala kvinnor) oregelbundna menstruationer och pruritus vulvae.
Illamående och kräkningar kan förekomma.
Yrsel, slöhet, depression, irritabilitet och dysfunktion i hjärnan har beskrivits.
Reversibel retinopati med makulärt ödem har rapporterats efter höga kumulativa doser och hornhinneförändringar kan inträffa.
Trombocytopeni eller leukopeni har associerats med tamoxifenbehandling.
Tromboembolism, som kan bero på sjukdomen snarare än behandlingen, har registrerats hos kvinnor som fick tamoxifen för bröstcancer.
Kontraindikationer: Graviditet är en absolut kontraindikation på grund av de anti-östrogena effekterna.
Inträdesvägar: Oral: Vanlig inträdesväg Absorption per exponeringsväg: Toppkoncentrationer inträffar 4-7 timmar efter oral dosering.
Toppkoncentrationerna efter en enda oral dos är cirka 40 u / l.
Distribution per exponeringsväg: Tamoxifen är mer än 99% proteinbundet i serum, främst till albumin.
Hos patienter med bröstcancer är koncentrationen av tamoxifen och dess metaboliter i pleural, perikardiell och peritoneal effusionsvätska mellan 20 och 100% av de i serum, men endast spårmängder kommer in i cerebrospinalvätskan.
Koncentrationerna i bröstcancervävnad överstiger de i serum.
Distributionsvolymen är 50-60 l / kg.
Biologisk halveringstid per exponeringsväg: Elimineringen är bifasisk, med en initial halveringstid på cirka 7 timmar och en terminal halveringstid på 7-11 dagar.
Ämnesomsättning: Tamoxifen citrat N-desmetyl-tamoxifen, 4-hydroxitamoxifen, 4-hydroxi-N-desmetyl-tamoxifen och N-desdimetyl-tamoxifen. Eliminering genom exponeringsväg: Den viktigaste utsöndringsvägen är via gallan när metaboliter och enterohepatisk recirkulation sker.
Mindre än 1% utsöndras i urinen.
Åtgärdssätt: Toxikodynamik: De negativa effekterna som observeras beror främst på dess anti-östrogeneffekt, eftersom Tamoxifen och vissa av dess metaboliter motverkar effekterna av östrogener i östrogenkänsliga vävnader.
Farmakodynamik: Tamoxifen och flera av dess metaboliter (i synnerhet 4-hydroxytamoxifen) binder till nukleära östrogenreceptorer i östrogenkänsliga vävnader, och även till ett mikrosomalt protein som kallas antiöstrogenbindningsstället.
Tamoxifen stör den fysiologiska sekvensen genom vilken östrogen binds till dess receptor, translokeras i kärnan och aktiverar sedan messenger-RNA-syntes.
Även om tamoxifenreceptorkomplexet transporteras i kärnan på samma sätt som östrogenreceptorkomplex misslyckas det att aktivera syntes av mRNA.
Karcinogenicitet: En fallkontrollstudie visade en signifikant ökad relativ risk för carcinom i livmodern hos kvinnor som tidigare behandlats med tamoxifen och som tidigare haft strålbehandling med livmodern.
Studien visade en ökning av den relativa risken med enbart tamoxifen-behandling som inte var statistiskt signifikant.
Teratogenicitet: Studier på neonatala manliga och kvinnliga möss i relativa doser som är tio gånger högre än de som används hos människor har visat onormala könsorganskanaler.
Interaktioner: Tamoxifen förstärker den antikoagulantiska effekten av warfarin, och denna interaktion kan vara livshotande.
Huvudsakliga biverkningar: Biverkningarna är vanligtvis milda.
Trombocytopeni, leukopeni, tromboembolism, peliosis hepatis och hyperlipidemi har nämnts i fallrapporter.
Svår hyperkalcemi kan sällan uppstå när behandling påbörjas hos patienter med benmetastaser.
Kronisk förgiftning: Förtäring: Retinalskada och keratit har rapporterats hos patienter efter stora kumulativa doser av tamoxifen i mer än 1 år, men ibland med mindre doser.
Det verkar finnas samband mellan långvarig administration av tamoxifen och proliferation av endometri.
Neurologisk: CNS: Ett fall av depression, synkope och inkoordination har beskrivits under terapi med 10 mg två gånger dagligen.
Symtomen försvann när tamoxifen avbröts och uppträdde igen när behandlingen startades om.
Gastrointestinal: Illamående och kräkningar uppträder med terapeutiska doser hos vissa patienter och förväntas i överdosering.
Lever: Ett dödligt fall av peliosis hepatis har rapporterats hos en kvinna som behandlats med tamoxifen i 2 år efter mastektomi för karcinom.
Urin: Annat: Ett fall av ihållande nattlig priapism har rapporterats.
Endokrina och reproduktiva system: De anti-östrogena effekterna av tamoxifen hos premenopausala kvinnor som får terapeutiska doser kan orsaka oregelbundna menstruationer.
Anti-östrogena biverkningar hos kvinnor som behandlas med tamoxifen inkluderar vasomotoriska symtom och vaginal blödning och pruritus vulvae.
Ögon, öron, näsa, hals: lokala effekter: Behandling har förknippats med förändringar i näthinnan och hornhinnan.
Hematologisk: Tromboembolism kan vara vanligare hos patienter som behandlas med tamoxifen, men detta är inte säkert, eftersom patienter med cancer är i ökad risk ändå.
En liten minskning av antitrombin III-koncentrationen noterades i en studie av 11 postmenopausala kvinnor behandlade med tamoxifen, men den var kliniskt obetydlig och ingen signifikant reduktion sågs hos en grupp av premenopausala kvinnor.
Trombocytopeni och leukopeni kan uppstå under terapi, men är vanligtvis inte allvarliga.
Ett fall av allvarligt myelosuppression har rapporterats.
Vätske- och elektrolytstörningar: Allvarlig hyperkalcemi, förknippad med ökad benresorption, har noterats när patienter med benmetastaser påbörjade behandlingen.
Andra: Allvarlig hyperlipidemi ses ibland och har tillskrivits en östrogen effekt.
Särskilda risker: Graviditet, amning och enzymbrister.
Djur / växtstudier: Hos vissa djurarter uppvisas östrogena agonisteffekter vid doser motsvarande 10-100 gånger den mänskliga terapeutiska dosen.
Mutagenicitet: Tamoxifen tros inte vara mutagen Tamoxifen citrat
Bevis för cancerframkallande egenskaper:
Hos människor finns det tillräckligt med bevis för tamoxifens cancerframkallande effekt för att öka risken för endometrial cancer och det finns avgörande bevis för att tamoxifen minskar risken för kontralateral bröstcancer hos kvinnor med tidigare diagnos av bröstcancer.
Det finns otillräckliga bevis hos människor för tamoxifens cancerframkallande egenskaper i andra organ.
Det finns tillräckliga bevis i försöksdjur för tamoxifens cancerframkallande egenskaper.
Helhetsbedömning: Tamoxifen är cancerframkallande för människor (grupp 1) och det finns avgörande bevis för att tamoxifen minskar risken för kontralateral bröstcancer
Tamoxifen: känd för att vara en cancerframkallande människa
Icke-mänskliga toxicitetsutdrag:
LABORATORISKA DYR: Kronisk exponering eller karcinogenicitet / Studier på råttor i doser av 5, 20 och 35 mg per kg kroppsvikt (mg / kg) per dag i upp till 2 år fann en ökad förekomst av hepatocellulärt karcinom vid alla doser
LABORATORISKA DYR: Kronisk exponering eller karcinogenicitet / äggstockscancer hos Granulosa-celler och interstitiella celltestulära tumörer observerades hos möss som fick tamoxifen
LABORATORISKA DYR: Utvecklings- eller reproduktionstoxicitet / Inga teratogena effekter observerades hos apor som fick tamoxifen under organogenesperioden eller den sista halvan av graviditeten
LABORATORISKA DYR: Utvecklings- eller reproduktionstoxicitet / En serie av nio kemikalier med varierande struktur och östrogenicitet undersöktes med avseende på biokemiska determinanter för deras relativa förmåga att förändra normal embryonal tillväxt och utvecklingsmönster under organogenes hos råttor.
För att kringgå de potentiellt förvirrande påverkningarna av moderfaktorer, jämfördes de direkta effekterna av steroida och icke-steroida östrogener på odlade hela embryon vid att producera lätt mätbar embryotoxicitet men låg embryolethalitet (2-20%).
Icke-steroida östrogener inkluderade tamoxifen.
Tamoxifen, ett svagt östrogen som också uppvisar antiöstrogena egenskaper, studerades för möjliga interaktiva effekter med potenta östrogener.
Prosencephalic hypoplasia var den abnormitet som observerades mest konsekvent.
Embryotoxicitet dämpades varken av tamoxifen eller var relaterad till östrogen styrka eller steroidstruktur, men påverkades starkt och oförutsägbart av biotransformationella determinanter.
Närvaro av ett cytokrom P450-beroende oxidationssystem i odlingsmediet resulterade i slående minskade effekter på embryotoxicitet av tamoxifen
LABORATORISKA DYR: Utvecklings- eller reproduktionstoxicitet / C57BL / Tw-möss för män och kvinnor fick 5 dagliga injektioner av 100 g tamoxifen från början på födelsedagen (tamoxifen-möss).
Hos obehandlade fostermöss på dräktningsdagen 18 var huvuddelen av skamben och ischiala ben brosk.
Vid mer än 30 dagars ålder uppvisade emellertid obehandlade möss fullständigt förkalkat bäckenben, medan i åldersmatchade tamoxifenmöss förblev större delen av korsningsregionerna i bäckenet brosk.
Behandling med tamoxifen som började inom 5 dagar efter åldern orsakade urinblåsa med eller utan bröstbråck.
Könsbandet i tamoxifen-möss i åldrarna 30-540 dagar expanderades markant jämfört med det i åldersmatchade kontroller.
Den permanenta kondrififieringen i bäckenet hittades i alla möss som fick tamoxifen med början inom 10 dagar.
Däremot inducerade neonatala behandlingar av möss med andra antiöstrogener, klomifen och nafoxidin (100 ug / dag) varken permanent kondrifikation i bäckenet eller utvidgning av könsbandet eller bråck.
Dessa fynd tyder på att tamoxifen har en specifik effekt på symfysisk pubis och vissa korsningsområden i utvecklingsbäckenet hos möss när de ges neonatalt
LABORATORISKA DYR: Utvecklings- eller reproduktionstoxicitet / I fertilitetsstudier i råttor och teratologiundersökningar hos kaniner som använde doser vid eller under de som användes hos människor, observerades en lägre förekomst av äggimplantation och en högre förekomst av fosterdöd eller försenad i uterotillväxt. med långsammare inlärningsbeteende hos vissa råtta avkommor jämfört med historiska kontroller, även om denna senare effekt inte är tydligt fastställd
GENOTOXICITY / Antiestrogen tamoxifen, som alltmer används som adjuvansbehandling för bröstcancer, har visat sig kovalent modifiera DNA från gnagare.
Till exempel innehöll lever-DNA från kvinnliga Sprague-Dawley-råttor behandlade med en enda injektion av tamoxifen två DNA-addukter.
Fyra ytterligare DNA-addukter bildades och adduktkoncentrationen ökade 5- 7- och 10-15 gånger efter tre respektive sex tamoxifen-injektioner från nivåer som observerades efter en enda dos.
Uppsamling av DNA-addukter med upprepade administreringar av tamoxifen till gnagare kan göra detta läkemedel till ett dåligt val för kronisk förebyggande behandling av bröstcancer
GENOTOXICITY / Ingen genotoxisk potential påträffades i ett konventionellt batteri in vivo och in vitro-test med prokaryota och eukaryota testsystem med läkemedelsmetaboliserande system närvarande.
Emellertid har ökade nivåer av DNA-addukter funnits i leverna hos råttor utsatta för tamoxifen.
Tamoxifen har också visat sig öka nivåerna av mikronukleusbildning in vitro i humant lymfoblastoidcellinje (MCL-5)
National Toxicology Program Studies:
För att bedöma potentiell effekt av ”långvarig” exponering för Sprague-Dawley-råttor, respektive TAM, 3TAM respektive 10TAM) på grupper om 29 kvinnliga Sprague-Dawley-råttor från 6 veckor före samliv till GD (Gestation Day) 7.
Den kvinnliga F0-generationen började exponera som vuxna och uppföddes en gång för att producera F1-generationen.
F1-vuxna uppföddes en gång för att producera en F2-generation.
Parametrar utvärderade under studiens gång inkluderade kroppsvikt, foderkonsumtion, kliniska observationer, estrocyclicitet, reproduktionsförmåga, anogenitalt avstånd, överlevnad av valpar, sexuell utveckling, spermieranalys, grov patologi, organvikter och begränsad / utvald histopatologi.
En addnl toxokokinetisk fas av insamling av blod och vävnader inkluderades vid utvalda tidpunkter (data presenterades separat).
En dosintervallundersökning med en exponering på 2 veckor före samliv och fortsätter till / graviditetsdag / 7 vid dosnivåer av 0, 3, 10, 30, 100 och 300 mg / kg / dag Baserat på upptäckten av ingen levande valpar = eller> 30 mg / kg / dag I F0- och F1-parningsförsöken var det små minskningar (p> 0.
TAM-grupp (hög dos) jämfört med kontroller.
I F0-parningsstudien minskades graviditets- och fertilitetsindex (13/29 vs.
I F1-parningsstudien minskades parningsindex & graviditetsindex (13/20 vs.
I F0-parningsstudien fanns också en ökning i graviditetslängden i 10TAM-gruppen (22.
Det konstaterades flera skillnader i estrocyclicitet.
I F0-dammarna under doseringen var det en skillnad i tiden som spenderades i de olika eströstadierna i 3TAM- och 10TAM-dammarna jämfört med kontrollerna.
Efter avvänjning när F0-dammarna inte doserades, var estrocykler jämförbara.
I F1-dammarna fanns det inga skillnader utom för en minskning i antalet kvinnor med regelbundna cykler i 10TAM-gruppen jämfört med kontroller (27/33 vs.
Den enda skillnaden i de uppmätta reproduktions- och utvecklingsparametrarna var en minskning (22%) i könsförhållandet för F2-ungar födda vid liv (man / totalt) i 10TAM-gruppen jämfört med kontroll.
Även om det inte var signifikant minskade antalet män (21%), kvinnor ökade (25%) och kombinerade män och kvinnor minskade (5%).
Inga behandlingsrelaterade skillnader noterades i data om manliga spermier hos F1-män eller i grova nekropsifynd i reproduktionsvägen eller organviktsdata hos F1- eller F2-män och kvinnor.
Resultaten av denna studie tyder på att TAM & 10TAM baserat på en förändring i estrisk cyklicitet & en möjlig minskning i antalet manliga valpar i F2-kullen i 10TAM-gruppen men inte påverkade F0- eller F1-föräldrarnas förmåga att reproducera och påverkade inte resultera i en ökad förekomst av avvikelser i reproduktionsvägarna i F1-avkommor eller i F2-avkommorna.
Den ingen observerbara nivån (NOAEL) i denna studie var 1TAM Tamoxifen citrat
Ekotoxicitetsvärden:
Arter: Acartia tonsa (Calanoid copepod).
Förhållanden: saltvatten.
Koncentration: 49 ug / L (95% konfidensgräns: 26 till 91 ug / L) under 5 dagar.
Effekt: utveckling, utveckling, allmän /> 99% aktiv ingrediens /
Metabolism / farmakokinetik:
Metabolism / Metabolites:
Tamoxifen metaboliseras i stor utsträckning efter oral administrering.
N-desmetyltamoxifen är den viktigaste metaboliten som finns i plasma.
N-desmetyltamoxifenaktivitet liknar tamoxifen.
Hydroxytamoxifen och ett primärt alkoholderivat av sidokedjan av tamoxifen har identifierats som mindre metaboliter i plasma.
Tamoxifen är ett substrat av cytokrom P450 CYP3A, CYP2C9 och CYP2D6 och en hämmare av P-glykoprotein.
Thomson / Micromedex.
Läkemedelsinformation för vårdpersonalen.
Volym 1, Greenwood Village, CO.
PEER REVIEWED ** Tamoxifen metaboliseras snabbt och omfattande, främst genom demetylering och i liten grad genom efterföljande deaminering och även genom hydroxylering.
Inledande studier antydde att 4-hydroxytamoxifen (metabolit B) var läkemedlets huvudmetabolit, men efterföljande studier med förbättrade analysmetoder har visat att 4-hydroxytamoxifen är en mindre metabolit och att huvudmetaboliten är N-desmetyltamoxifen (metabolit X).
Den biologiska aktiviteten hos N-desmetyltamoxifen verkar vara lik den för tamoxifen.
N-Desmetyltamoxifen genomgår demetylering för att bilda N, N-desdimetyltamoxifen (metabolit Z) som genomgår efterföljande deamination för att bilda den primära alkoholmetaboliten (metaboliten Y).
Både 4-hydroxytamoxifen och ett sidokedja-primärt alkoholderivat av tamoxifen har identifierats som mindre metaboliter i plasma.
Dihydroxytamoxifen och en oidentifierad metabolit (metabolit E) har också detekterats i plasma i små mängder.
Vid kontinuerlig administrering av tamoxifen är serumkoncentrationerna av N-desmetyltamoxifen i allmänhet ungefär 1-2 gånger de av oförändrad tamoxifen, medan de för N, N-desdimetyltamoxifen är ungefär 20-40% de av oförändrad tamoxifen och de för den primära alkoholmetaboliten är ungefär 5-25% av oförändrad tamoxifen.
E verkar vara mindre än 5% av de av oförändrat tamoxifen.
American Hospital Formulary Service.
AHFS läkemedelsinformation.
American Society of Health-System Pharmacists, Bethesda, MD.
PEER-ÖVERSIKT ** Flera metaboliter av tamoxifen, inklusive 4-hydroxi-N-desmetyltamoxifen, 4-hydroxytamoxifen, N-desmetyltamoxifen, den primära alkoholen och N-desdimetyltamoxifen, identifierades och deras koncentration bestämdes i vätskor och avföring från patienter som fick kronisk tamoxifenbehandling .
De biologiska prover som undersöktes var serum-, pleural-, perikardie- och peritoneala effusioner, cerebrospinalvätska, saliv, gall, feces och urin.
I serum var själva tamoxifen och metaboliterna N-desmetyltamoxifen och N-desdimetyltamoxifen de rådande arterna, men signifikanta mängder av metaboliterna den primära alkoholen, 4-hydroxytamoxifen, 4-hydroxi-N-desmetyltamoxifen detekterades också.
Cirka 3 timmar efter läkemedelsintag tamoxifen såväl som N-desmetyltamoxifen, en N-desdimetyltamoxifen) visade en topp i serum.
Detta kan förklaras genom effektiv metabolism av metabolitprekursorn innan den distribueras till perifera fack.
Vid läkemedelsavlägsnande visade alla metaboliter första ordningens elimineringskurvor som parallellt med tamoxifen, vilket antydde att deras eliminationshastighet överskred tamoxifens nivå och att serumnivåerna är produktionshastighet begränsade.
Proteinbindningen av tamoxifen och dess huvudsakliga serummetaboliter (den primära alkoholen, N-desmetyltamoxifen, N-desdimetyltamoxifen) bestämdes och visade sig vara högre än 98%.
Albumin var den dominerande bäraren för tamoxifen i human plasma.
Samlingen av tamoxifen och dess metaboliter i pleurala, perikardiella och peritoneala effusioner motsvarade de som detekterades i serum, vilket motsvarar ett effusion / serumförhållande mellan 0.
Endast spårmängder av tamoxifen och metabolit N-desmetyltamoxifen detekterades i cerebrospinalvätska (CSF / serumförhållande mindre än 0.
I saliv överskred concn av tamoxifen och N-desmetyltamoxifen mängderna av fritt läkemedel i serum, vilket antyder aktiv transport eller fångst av dessa föreningar i salivkörtlarna.
Galla och urin var rika på de hydroxylerade, konjugerade metaboliterna (den primära alkoholen, 4-hydroxytamoxifen, 4-hydroxi-N-desmetyltamoxifen, medan i avföring var okonjugerad metabolit B och tamoxifen den dominerande arten.
Prover samlades in från bröstcancerpatienterna som fick tamoxifen under 7-180 dagar och med den sista dosen som togs inom 28 timmar före kirurgiskt avlägsnande av tumören.
Samlingen av tamoxifen och dess metaboliter var upp till 46 gånger högre i hjärnmetastatisk tumör och hjärnvävnad än i serum.
Metabolit N-desmetyltamoxifen var den vanligaste arten följt av tamoxifen och metabolit N-desdimetyltamoxifen.
Små men betydande mängder av de hydroxylerade metaboliterna, trans-1 (4-beta-hydroxietoxifenyl) -1,2-difenylbut-1-en, 4-hydroxytamoxifen och 4-hydroxi-N-desmetyltamoxifen detekterades i de flesta prover.
Förhållandena mellan tamoxifen och olika metaboliter var liknande i tumör, hjärna och serum.
Detta är den första rapporten om fördelningen av tamoxifen och metaboliter till mänsklig hjärna och hjärntumör, och uppgifterna utgör en grund för ytterligare undersökning av de terapeutiska effekterna av tamoxifen på hjärnmetastaser från bröstcancer.
Absorption, distribution och utsöndring:
Tamoxifen verkar absorberas långsamt efter oral administrering, med maximala serumkoncentrationer som vanligtvis inträffar cirka 3-6 timmar efter en enda dos.
Graden av absorption hos människor har inte fastställts tillräckligt, men begränsade data från djurstudier tyder på att läkemedlet är väl absorberat.
Data från djurstudier tyder också på att tamoxifen och / eller dess metaboliter genomgår omfattande enterohepatisk cirkulation
Efter oral administrering uppnår de högsta serumtamoxifenkoncentrationerna cirka 17 ng / ml efter en enda 10 mg dos, cirka 40 ng / ml efter en enda 20 mg dos och 65-70 ng / ml efter en enda 40 mg dos
Efter en enda oral dos av tamoxifen ligger de högsta serumkoncentrationerna av N-desmetyltamoxifen, läkemedlets huvudsakliga metabolit, vanligtvis från cirka 15-50% de av oförändrad tamoxifen.
N-desmetyltamoxifen sträcker sig i allmänhet från cirka 1-2 gånger de av oförändrad tamoxifen.
Efter kontinuerlig administrering hos patienter som fick oralt tamoxifen 10 mg två gånger dagligen i 3 månader, har plasmakoncentrationen av tamoxifen och N-desmetyltamoxifen i genomsnitt cirka 120 ng / ml (intervall: 67-183 ng / ml) och 336 ng / ml (intervall) : 148-654 ng / ml)
Serumkoncentrationer av tamoxifen vid stabilt tillstånd uppnås vanligtvis efter 3-4 veckors kontinuerlig dosering, medan de för N-desmetyltamoxifen vanligtvis uppnås efter 3-8 veckors kontinuerlig dosering.
Serumkoncentrationer vid jämnt tillstånd kan uppnås snabbare med en belastningsdosregim, men det finns ingen terapeutisk fördel med en sådan regim
Distributionen av tamoxifen och dess metaboliter i människans kroppsvävnader och vätskor har inte karakteriserats fullt ut.
I en studie på ett begränsat antal kvinnor som fick radiomärkt tamoxifen före hysterektomi var koncentrationen av radioaktivitet i livmodervävnader större än i serum 4-96 timmar efter att läkemedlet gavs.
Tamoxifen-metaboliter fördelas till galla hos djur.
Distributionen av tamoxifen och dess huvudsakliga metaboliter i cytosol i mänsklig brösttumörvävnad tycks generellt parallella de relativa koncentrationerna som finns i serum, även om cytosolkoncentrationer kan uppvisa ännu större interindividuell variation än serumkoncentrationer
Det är inte känt om tamoxifen fördelas i mjölk
Primär väg / utsöndring är / gallvägar / fekal, mestadels som polära konjugat.
Studier på kvinnor som fick 20 milligram 14C tamoxifen har visat att cirka 65% av den administrerade dosen eliminerades från kroppen under en två veckors period.
Oförändrade läkemedel och okonjugerade metaboliter står för mindre än 30% av den fekala radioaktiviteten.
Sekundärväg: njure (endast små mängder)
Det utsöndrade ödet för tamoxifen och dess metaboliter har inte kännetecknats väl.
Efter oral administrering av en 20 mg dos av radiomärkt tamoxifen hos kvinnor utsöndrades ungefär 65% av den administrerade dosen i avföring under en två veckors period, främst som polära konjugat.
Oförändrade tamoxifen och N-desmetyltamoxifen har detekterats i urin i små mängder.
Hos djur verkar tamoxifen och / eller dess metaboliter genomgå en omfattande enterohepatisk cirkulation och utsöndras i avföring och urin som glukuronider, andra konjugat och oidentifierade polära metaboliter
Mängden tamoxifen bestämdes i hjärnmetastaser från patienter med bröstcancer och i de omgivande hjärnvävnaderna.
Prover samlades in från bröstcancerpatienterna som fick tamoxifen under 7-180 dagar och med den sista dosen som togs inom 28 timmar före kirurgiskt avlägsnande av tumören.
Förhållandena mellan koncentrationen av tamoxifen och olika metaboliter var liknande i tumör, hjärna och serum.
Detta är den första rapporten om fördelningen av tamoxifen och metaboliter till mänsklig hjärna och hjärntumör, och uppgifterna utgör en grund för ytterligare undersökning av de terapeutiska effekterna av tamoxifen på hjärnmetastaser från bröstcancer
Biologisk halveringstid:
Begränsade data antyder att tamoxifen har en fördelningshalveringstid på 7-14 timmar och en eliminationshalveringstid på cirka 5-7 dagar (intervall: 3-21 dagar).
Eliminationshalveringstiden för N-desmetyltamoxifen, huvudmetaboliten, beräknas vara 9-14 dagar
Handlingsmekanism:
Tamoxifen är ett nonsteroidalt medel med potenta antiöstrogena egenskaper.
Antiöstrogeneffekterna kan vara relaterade till tamoxifens förmåga att konkurrera med östrogen för bindningsställen i målvävnader som bröst.
Tamoxifen tävlar med östradiol för östrogenreceptorprotein i cytosoler härrörande från humana bröstadenokarcinom.
Det har visat sig att Tamoxifen hämmar induktionen av råttkirtelkarcinom inducerat av dimetylbensantracen (DMBA) och orsakar regression av redan etablerade DMBA-inducerade tumörer.
Tamoxifen verkar utöva sina antitumoreffekter genom att binda östrogenreceptorerna i denna råttmodell
Tamoxifen kan inducera ägglossning hos anovulatoriska kvinnor, vilket stimulerar frisättning av gonadotropinfrisättande hormon från hypotalamus, vilket i sin tur stimulerar frisättning av hypofysegonadotropiner.
Hos oligospermiska män ökar tamoxifen serumkoncentrationer av luteiniserande hormon (LH), follikelstimulerande hormon (FSH), testosteron och östrogen
Tamoxifen är ett antiöstrogen som ofta används vid behandling av bröstcancer och bedöms för närvarande som ett profylaktiskt för dem med hög risk att utveckla tumörer.
Vi har funnit att tamoxifen och dess derivat är högaffinitetsblockerare av specifika kloridkanaler.
Denna blockad verkar vara oberoende av interaktionen mellan tamoxifen och östrogenreceptorn och återspeglar därför ett alternativt cellulärt mål.
En av de kliniska biverkningarna av tamoxifen är nedsatt syn och grå starr.
Kloridkanaler i linsen i ögat visade sig vara väsentliga för att upprätthålla normal lins hydrering och transmittans.
Dessa kanaler blockerades av tamoxifen och i organodling ledde tamoxifen till linsopacitet associerad med grå starr i kliniskt relevanta koncentrationer.
Dessa data antyder en molekylmekanism genom vilken tamoxifen kan orsaka bildning av grå starr och har konsekvenser för den kliniska användningen av tamoxifen och relaterade antiöstrogener
interaktioner:
Samtidig användning av Aminoglutetimid kan minska plasmakoncentrationerna av tamoxifen och N-desmetyltamoxifen
Samtidig användning av kumarinderivativa antikoagulantia kan leda till en signifikant ökning av antikoaguleringseffekten.
DCIS)
Samtidig användning av bromokriptin kan öka serumnivåerna av tamoxifen och N-desmetyltamoxifen
Samtidig användning av cytotoxiska medel kan leda till ökad risk för tromboemboliska händelser
Samtidig användning av letrozol kan minska plasmakoncentrationerna av letrozol
Samtidig användning av medroxyprogesteron kan leda till minskade plasmakoncentrationer av N-desmetyltamoxifen
Samtidig användning av fenobarbital eller rifampin kan minska plasmakoncentrationerna av tamoxifen
Överdriven antikoagulering som tillskrivs en interaktion mellan tamoxifen och warfarin rapporteras hos 6 patienter med neoplasma med tromboembolisk sjukdom.
En patient utvecklade ett subduralt hematom och en annan hematuri.
I den första patienten drogs warfarin ut och i den andra ersattes fenindion.
Hos de återstående patienterna återförde reduktion av dosen warfarin protrombintider till terapeutiska värden.
En möjlig mekanism för interaktionen diskuterades också
Den cytotoxiska effekten av en kombination av interferoner (typ I och II) och tumörnekrosfaktor, med ett antestrogeniskt läkemedel, tamoxifen, undersöktes i den östrogenreceptorpositiva humana bröstcarcinomcellinjen, MCF-7.
Cytotoxicitet mättes med MTT-analysen.
I ett försök att definiera den molekylära basen för interaktionen mellan interferonerna och tumörnekrosfaktorn eller någon av cytokinerna med tamoxifen, var induktionsegenskaperna för ett antal interferon-inducerade mRNA som svar på interferoner, tumornekrosfaktor och tamoxifen studeras.
Vi observerade en förstärkning av den cytotoxiska effekten av tumörnekrosfaktor när den kombinerades med tamoxifen.
Det verkar finnas en överlappning i signalmekanismer för interferoner och tumörnekrosfaktor eftersom två av de interferoninducerbara generna, 1-8 och 6-16 också induceras av tumörnekrosfaktor.
RNA 1-8 inducerades av både interferon-alfa (typ I) och interferon-gamma (typ II).
Vi drar slutsatsen att tumörnekrosfaktor förstärker de cytotoxiska effekterna av tamoxifen i MCF-7-celler och att de tre cytokinerna interferon-alfa, interferon-gamma och tumörnekrosfaktor delar vissa vägar som leder till specifik induktion av vissa cytokinresponsiva gener.
En ny kombination av två läkemedel av tamoxifen och rifampicin har undersökts för behandling av gallvägsassocierade maligniteter.
Deras effekter, ensamma och i kombination, på humana tumörceller studerades med användning av två pancreaskarcinomcellinjer.
MIA PaCa-2 och AsPC-1, och en gallblåsarkarcinomcellinje, G-415.
Hämning av tillväxt användes som slutpunkt.
Cellerna skilde sig åt i känslighet för ekvimolära doser av de två läkemedlen som gavs som enskilda medel.
Kombinerade doser av rifampicin och tamoxifen resulterade i tillväxtinhibering i en utsträckning som tyder på tillsatseffekter eller synergistiska läkemedelseffekter.
Mer detaljerad analys genomfördes, inbegripet produktionen av ett ”hölje av additivitet” för varje cellinje.
En tillsatseffekt av läkemedelskombinationen visade sig inträffa i alla tre cellinjerna, vilket tillhandahöll en grund för användning av denna nya två läkemedelskombination vid behandling av gallvägsassocierade maligniteter.
Tamoxifen, en selektiv östrogenreceptormodulator (SERM), omvandlas till 4-hydroxitamoxifen och andra aktiva metaboliter med cytokrom P450 (CYP) enzymer.
Selektiva serotoninåterupptagshämmare (SSRI), som ofta föreskrivs för att lindra tamoxifenassocierade värmevallningar, kan hämma CYP.
I en prospektiv klinisk prövning testade vi effekterna av samtidig administrering av tamoxifen och SSRI-paroxetin, en hämmare av CYP2D6, på tamoxifenmetabolismen.
Tamoxifen och dess metaboliter mättes i plasma hos 12 kvinnor av känd CYP2D6-genotyp med bröstcancer som tog adjuvans tamoxifen före och efter 4 veckors samadministrerad paroxetin.
Undersökare / bedömde den hämmande aktiviteten för rena tamoxifenmetaboliter i en östradiolstimulerad MCF7-cellproliferationsanalys.
För att bestämma vilka CYP-isoformer som var involverade i metabolismen av tamoxifen till specifika metaboliter, användes CYP-isoformspecifika hämmare /.
Alla statistiska test var dubbelsidiga.
Författarna / separerade, renade och identifierade metaboliten 4-hydroxi-N-desmetyl-tamoxifen, som vi gav namnet endoxifen.
Plasmakoncentrationerna av endoxifen minskade statistiskt signifikant från ett medelvärde på 12.
L innan paroxetin samtidigt administreras till 5.
L efteråt (skillnad = 6.
L, 95% konfidensintervall [Cl] = 2.
Endoxifenkoncentrationer minskade med 64% (95% CI = 39% till 89%) hos kvinnor med en vildtyp CYP2D6-genotyp men endast med 24% (95% CI = 23% till 71%) hos kvinnor med en variant CYP2D6-genotyp ( P =.
Endoxifen och 4-hydroxitamoxifen inhiberade östradiolstimulerad MCF7-cellproliferation med lika stor kraft.
In vitro inhiberade troleandomycin, en hämmare av CYP3A4, demetyleringen av tamoxifen till N-desmetyl-tamoxifen med 78% (95% CI = 65% till 91%), och kinidin, en hämmare av CYP2D6, reducerade den efterföljande hydroxyleringen av N -desmetyl-tamoxifen till endoxifen med 79% (95% Cl = 50% till 108%).
Endoxifen är en aktiv tamoxifenmetabolit som genereras via CYP3A4-medierad N-demetylering och CYP2D6-medierad hydroxylering.
Samtidig administrering av paroxetin minskade plasmakoncentrationen av endoxifen.
Våra data antyder att CYP2D6-genotyp och läkemedelsinteraktioner bör övervägas hos kvinnor som behandlas med tamoxifen
Tamoxifen, en selektiv östrogenreceptormodulator (SERM), omvandlas till 4-hydroxitamoxifen och andra aktiva metaboliter med cytokrom P450 (CYP) enzymer.
Selektiva serotoninåterupptagshämmare (SSRI), som ofta föreskrivs för att lindra tamoxifenassocierade värmevallningar, kan hämma CYP.
I en prospektiv klinisk prövning testade vi effekterna av samtidig administrering av tamoxifen och SSRI-paroxetin, en hämmare av CYP2D6, på tamoxifenmetabolismen.
Författarna / separerade, renade och identifierade metabolitten 4-hydroxi-N-desmetyl-tamoxifen, som / var / namngav endoxifen.
Plasmakoncentrationerna av endoxifen minskade statistiskt signifikant från ett medelvärde på 12.
L innan paroxetin samtidigt administreras till 5.
L efteråt (skillnad = 6.
L, 95% konfidensintervall [Cl] = 2.
L) (P =.
Endoxifen är en aktiv tamoxifenmetabolit som genereras via CYP3A4-medierad N-demetylering och CYP2D6-medierad hydroxylering.
Samtidig administrering av paroxetin minskade plasmakoncentrationen av endoxifen.
Våra data antyder att CYP2D6-genotyp och läkemedelsinteraktioner bör övervägas hos kvinnor som behandlas med tamoxifen
Farmakologi:
Terapeutiska användningar:
Anticarcinogena medel.
Antineoplastiska medel, hormonella.
Cancerframkallande ämnen.
Östrogenantagonister
antiöstrogen
Tamoxifen är indicerat för adjuvant behandling av axillär nodenegativ bröstcancer hos kvinnor efter total mastektomi eller segmental mastektomi, axillär dissektion och bröstbestrålning.
Data är otillräckliga för att förutsäga vilka kvinnor som mest sannolikt kommer att ha nytta och för att avgöra om tamoxifen ger någon fördel hos kvinnor med tumörer på mindre än 1 cm.
Tamoxifen är / också / indikerat för adjuvant behandling av axillknutepositiv bröstcancer hos postmenopausala kvinnor efter total mastektomi eller segmental mastektomi, axillär dissektion och bröstbestrålning.
I vissa tamoxifen-adjuvansstudier har de flesta fördelarna hittills varit i undergruppen med fyra eller fler positiva axillära noder.
Inkludera i amerikansk produktetikett /
Tamoxifen är indicerat för att minska risken för att utveckla bröstcancer hos kvinnor som har fastställts ha hög risk för att utveckla denna cancer.
En kvinna anses ha en hög risk om hon är minst 35 år och har en 5-års förutsedd risk att utveckla bröstcancer större än eller lika med 1.
Ingår i amerikansk produktetikett /
Tamoxifen är indicerat för att minska risken för invasiv bröstcancer hos kvinnor med duktalt karcinom in situ (DCIS) som har genomgått bröstkirurgi och strålbehandling.
Ingår i amerikansk produktetikett /
Tamoxifen indikeras i kombination med andra medel vid behandling av malignt melanom.
INTE ingår i amerikansk produktetikett /
Tamoxifen, i kombination med andra medel, anses som rimlig medicinsk terapi vid någon tidpunkt vid hanteringen av endometrialt karcinom.
INTE inkluderas i amerikansk produktetikett /
En 52 år gammal kvinna med hepatocellulärt karcinom behandlades framgångsrikt med tamoxifen.
Tumören involverade iv-leversegment med hilarförlängning och gallvägsobstruktion, var oåterkallelig och hade förbehandlats med hormon-kemoterapi.
Tamoxifen-behandling inducerade ett partiellt svar på 6 mo, med normalisering av serumbilirubin, minskning av alfa-fetoproteinnivån och förbättring av PS och var fri från toxicitet.
Vid sjukdomsprogression gav intra-arteriell kemoterapi med Cis-platina och 5-FU ytterligare 4 mo-svar, tills sjukdomens progression och utgång i leverkoma.
Tamoxifen-terapi är ett användbart verktyg för hantering av hepatocellulärt karcinom
Läkemedelsvarningar:
Fall av tamoxifenassocierad hepatotoxicitet har beskrivits, inklusive kolestas med eller utan cytolys och steatohepatit.
Vi rapporterar fallet av en kvinnlig patient som utvecklade leverändringar under kontinuerlig behandling med tamoxifen
Det har nyligen rapporterats om blödning efter menopaus från endometrial polypper hos kvinnor som fick tamoxifenbehandling mot bröstcancer.
Författarna / beskriver ytterligare fyra patienter som presenterade med vaginal blödning och betonar patologin.
Dessa polypper visade cystiskt utvidgade körtlar i alla fall och stromal decidualisering i två.
Mekanismerna genom vilka tamoxifen kan påverka utvecklingen av dessa polyper diskuteras
Denna fallrapport tjänar till att betona två viktiga funktioner i metastaserat bröstkarcinom.
För det första kan den tamoxifen-inducerade flänsen, även om det är ett sällsynt och självbegränsande fenomen, vara dödligt och måste därför erkännas och behandlas snabbt.
För det andra har de patienter som uppvisar hyperkalcemi, som en del av tamoxifen-inducerad tumörbloss, alltid metastaserad sjukdom, men de kan ha en hållbar prognos om detta är begränsat till skelettet
Det fjärde fallet av heterolog mesodermal tumör i livmoderkroppen, som utvecklades, år efter tamoxifenbehandling för bröstcancer hos en postmenopausal kvinna utan tidigare bäckenbestrålning, presenteras med sammanfallande endometrios och endometrialt intraepitelialt karcinom
Tamoxifen används alltmer i adjuvant endokrin terapi för patienter med bröstcancer efter kirurgi och vid kemoprevention för högriskpatienter.
Vi presenterar ett fall av bilateral ovariell cystautveckling med på varandra följande unilateral cysta torsion och förhöjd serumöstradiol hos en premenopausal patient som behandlades med tamoxifen efter bröstkonserverande operation
Två manliga patienter rapporteras som blev impotenta medan de fick tamoxifen som behandling för bröstcancer.
Testosteronnivåerna vid denna tidpunkt var / liknar / de som hittades efter kastrering och de återkom till det normala efter att tamoxifen togs tillbaka
Fyra patienter med livmodersarkom som hade tidigare använt tamoxifenanvändning för tidigare bröstcancer presenteras i denna studie.
Medeltiden för exponering för tamoxifen var 6 (intervall 3-11) år, och den genomsnittliga kumulativa dosen av läkemedlet var 43.
Alla patienter var postmenopausala, och medelåldern var 66 (intervall 61-73) år vid diagnos av malignitet i livmodern.
Två (50%) patienter hade malign uterus-mullerian tumör, och två (50%) hade leiomyosarkom.
Hos en (25%) diagnostiserades patienten med endometrial biopsi för en postmenopausal vaginal blödning.
Alla patienter genomgick operation + eller – adjuvansbehandling (kemoterapi och / eller strålbehandling), och två (50%) patienter dog på grund av sarkom.
Som en följd av detta krävs tidig upptäckt av tamoxifenrelaterat livmodersarkom för ordnad gynekologisk undersökning hos patienter som har tidigare använt tamoxifenanvändning för tidigare bröstcancer
I en studie för att bestämma den maximala tolererade dosen av tamoxifen inträffade akut neurotoxicitet, manifesterad med tremor, hyperreflexi, ostabil gång och yrsel hos patienter med avancerat (metastaserat) karcinom som fick mycket höga doser av tamoxifen (i.
Dessa biverkningar inträffade inom 3-5 dagar efter inledningen av tamoxifenbehandling och försvann 2-5 dagar efter avslutad läkemedel.
Inga permanenta neurologiska följder rapporterades hos dessa patienter.
Även om ett orsakssamband till tamoxifen inte har fastställts rapporterades anfall hos minst en av dessa patienter flera dagar efter avslutad läkemedel och försvinnande av negativa nervsystemeffekter.
Hos patienter som fick laddningsdoser som överstiger 250 mg / kvm följt av underhållsdoser på 80 mg / kvm administrerade två gånger dagligen rapporterades förlängning av QT-intervallet
I BCPT hade kvinnor utan historia av lungemboli som fick tamoxifen ungefär tre gånger ökat risken för att utveckla en lungemboli (18 mot 6 fall).
Tre kvinnor i studien, som alla fick tamoxifen, dog av lungemboli.
Av fallen med lungemboli inträffade 87% hos kvinnor minst 50 år vid randomiseringen.
BCPT, episoder av lungemboli inträffade i genomsnitt 27 månader (intervall: 2-60 månader) efter inledningen av terapin med läkemedlet
Även om skillnaden inte var signifikant ökade risken för djupvenetrombos (relativ risk för 1.
BCPT (35 mot 22 fall).
En liknande ökning av den relativa risken för djupvenetrombos observerades hos kvinnor i åldern 49 år och yngre som hos kvinnor 50 år eller äldre, även om färre händelser inträffade hos yngre kvinnor.
Kvinnor som hade tromboemboliska händelser riskerade för en andra relaterad händelse (7 av 25 kvinnor som fick placebo och 5 av 48 kvinnor som fick tamoxifen).
Bland kvinnor som fick tamoxifen i BCPT inträffade episoder av djupvenetrombos i genomsnitt 19 månader (intervall: 2-57 månader) efter inledande av terapi med läkemedlet
Trombotiska händelser, inklusive trombos i djupven, lungemboli och ytlig flebit, har också rapporterats hos 1.
Koagulationsfaktorabnormaliteter har observerats vid förlängd tamoxifenbehandling vid vanliga doser, och antitrombin III, fibrinogen och trombocytantal har minskat minimalt
Även om skillnaden inte var signifikant observerades en ökning av förekomsten av stroke vid kvinnor som fick tamoxifen (38 händelser) jämfört med placebo (24 händelser) i BCPT (relativ risk för 1.
Hemorragiska stroke svarade för 10 av 38 (26%) eller 6 av 24 (25%) stroke hos kvinnor som fick tamoxifen respektive placebo.
Tillfälliga stroke svarade för 21 av 38 (55%) eller 14 av 24 (58%) stroke hos kvinnor som fick tamoxifen respektive placebo.
Bland kvinnor som fick tamoxifen eller placebo var 7 av 38 (18%) respektive 4 av 24 (17%) stroke av okänd etiologi.
Dödlig stroke inträffade hos 4 kvinnor som fick tamoxifen och hos 3 kvinnor som fick placebo.
Bland kvinnor som upplevde stroke inträffade 88% hos kvinnor 50 år eller äldre vid randomiseringen.
Bland kvinnor som fick tamoxifen i BCPT inträffade episoder av stroke i genomsnitt 30 månader (intervall: 1-63 månader) efter inledande av terapi med läkemedlet
Vasomotoriska symtom (dvs värmevallningar [blinkar]) förekommer oftare hos patienter som får tamoxifen än hos de som får placebo.
Varmtvätt är en av de vanligaste biverkningarna som rapporteras hos kvinnor som får tamoxifen för behandling eller förebyggande av bröstcancer.
I BCPT inträffade hettopp i 81% av kvinnorna som fick tamoxifen jämfört med 69% av dem som fick placebo.
Dessutom rapporterade fler kvinnor som fick tamoxifen jämfört med placebo varma flöden som var ganska lite eller extremt besvärande (46 mot 29%).
Tillbakadragande från rättegången på grund av heta flödor inträffade oftare bland kvinnor som fick tamoxifen kontra placebo (3
Hyperlipidemier har rapporterats hos patienter som får tamoxifen.
Hypertriglyceridemi har rapporterats hos patienter med bröstcancer som får tamoxifen och kan vara allvarliga, särskilt hos patienter med en känd historia av förhöjda triglyceridnivåer, såsom de som är förknippade med familjär hypertriglyceridemi.
Även om tamoxifen-inducerad hypertriglyceridemi kan reagera på avlägsnande av läkemedlet eller behandling med lipidsänkande medel, såsom fibrater, utvecklade minst en patient fulminant pankreatit och dog därefter.
Periodisk övervakning av plasmakoncentrationen av triglycerider rekommenderas hos patienter med förekommande hyperlipidemier under hela tamoxifenbehandlingen, eftersom hypertriglyceridemi kan komma att försenas
Vätskeansamling har rapporterats hos kvinnor som får tamoxifen som adjuvansbehandling för bröstcancer.
Ödem har också rapporterats hos kvinnor med metastaserad bröstcancer som fick tamoxifen
Vaginal urladdning och menstruations oregelbundenhet förekommer oftare hos patienter som får tamoxifen än hos de som får placebo.
Vaginal urladdning, förekom hos 55%, var en av de vanligaste biverkningarna som rapporterades bland kvinnor som fick tamoxifen för primärt förebyggande av bröstcancer i BCPT.
Dessutom rapporterade fler kvinnor som fick tamoxifen kontra placebo vaginal urladdning som var måttligt, ganska mycket eller extremt besvärande (29 mot 13%).
Tillbakadragande från försöket på grund av vaginal urladdning inträffade oftare bland kvinnor som fick tamoxifen kontra placebo (0.
Vaginal blödning kan uppstå med tamoxifenbehandling.
Vaginal torrhet och pruritus vulvae har rapporterats sällan hos kvinnor som får tamoxifen för metastaserande bröstcancer
En ökad förekomst av endometriförändringar, inklusive hyperplasi och polyper, har associerats med tamoxifen-terapi.
Den underliggande mekanismen för dessa förändringar verkar vara relaterad till östrogena egenskaper hos tamoxifen.
Endometrios och livmoderfibroider, eventuellt till följd av tamoxifens partiella östrogena aktivitet, har sällan rapporterats hos kvinnor som fick tamoxifen.
Dessutom har ovariecyster observerats hos ett litet antal premenopausala patienter med avancerad bröstcancer som har behandlats med tamoxifen.
En ökad förekomst av livmoderfibrer (hos premenopausala och postmenopausala kvinnor) och godartade ovariecyster (hos premenopausala kvinnor) noterades också hos kvinnor som fick tamoxifen i en studie för att förebygga bröstcancer
Förlust av libido och impotens har rapporterats hos vissa manliga patienter och resulterade i att tamoxifenbehandling avbröts.
Hos oligospermiska män som fick tamoxifenbehandling rapporterades ökad lutropin (luteiniserande hormon, LH), follitropin (follikelstimulerande hormon, FSH), testosteron och östrogenkoncentrationer.
Priapism har rapporterats hos minst en patient som fick tamoxifen
Muskuloskeletalsmärta och bensmärta har rapporterats hos patienter med bröstcancer som fick tamoxifen.
Ökad ben- och tumörsmärta eller floss har inträffat med tamoxifen-terapi för metastaserande bröstcancer och är ibland associerade med ett bra tumörrespons.
Patienter med ökad bensmärta kan behöva ytterligare smärtstillande medel.
Patienter med mjukvävnadssjukdom kan uppvisa plötsliga ökningar i storleken på förekommande lesioner, ibland förknippade med markant erytem i och omgivande lesioner, och / eller utveckling av nya lesioner.
Om bensmärta och sjukdomssvängningar uppträder syns de vanligtvis strax efter inledningen av tamoxifenbehandlingen och avtar vanligtvis snabbt.
Hantering av tamoxifen-relaterad flare inkluderar stödjande vård och eventuellt avbrott av behandlingen med läkemedlet, med efterföljande återinförande av terapi i en reducerad dos och gradvis ökning till den vanliga dosen
Hyperkalcemi, i vissa fall livshotande, kan uppstå under initial tamoxifenbehandling hos patienter med metastaserande bröstcancer som har benmetastaser.
Periodisk bestämning av serumkalciumkoncentrationer bör utföras under den första behandlingen hos dessa patienter (t.ex.
Om hyperkalcemi är svår bör läkemedlet avbrytas
Tamoxifen har sällan varit associerad med okulär toxicitet.
Retinopati, hornhinnens opacitet och minskad synskärpa har förekommit hos patienter som fick extremt höga doser av tamoxifen under mer än ett år.
Okulära effekter såsom synstörningar, minskning av färgvisionsuppfattning, hornhinneförändringar, grå starr, behov av gråoperation, optisk neurit, trombos i näthinnan, intraretinala kristaller, posterior subkapsulär opacitet och / eller retinopati har också rapporterats hos patienter som fick rekommenderade doser av drogen.
En något ökad hastighet för att utveckla grå starr och en större risk för att utveckla grå starr och genomgå en grå starr kirurgi observerades hos kvinnor som fick tamoxifen i BCPT
Förändringar i koncentrationen av leverenzym (t.ex.
AST [SGOT] eller ALT [SGPT] -koncentrationer) och ökade bilirubin- och / eller alkaliska fosfatas-koncentrationer har rapporterats hos patienter som fick tamoxifenbehandling.
Sällan har mer allvarliga leveravvikelser, inklusive fettförändringar i levern, kolestas, hepatit, levernekros och död inträffat.
Ett orsakssamband mellan dessa ogynnsamma levereffekter och tamoxifen har inte fastställts
Negativa GI-effekter av tamoxifen, inklusive illamående, anorexi, avsmak för mat och magkramper, har rapporterats hos patienter med bröstcancer
Biverkningar av nervsystemet som rapporterats hos patienter som får tamoxifen för metastaserande bröstcancer inkluderar yrsel, lätthet, huvudvärk, trötthet och mental depression
Trombocytopeni (trombocytantal på 50 000-100 000 cu m och sällan lägre) har ibland inträffat hos patienter som fick tamoxifen för behandling av bröstcancer.
Hemorragiska episoder har sällan inträffat hos patienter med svår trombocytopeni.
Neutropeni, pancytopenia och leukopenia (vita blodkroppar mindre än 3000 / cu m), ibland associerade med anemi och / eller trombocytopeni, har också rapporterats och kan vara allvarliga
Tunnning och / eller partiell förlust av hår förekommer sällan hos patienter som får tamoxifen för metastaserande bröstcancer.
Erythema multiforme, Stevens-Johnsons syndrom och bullous pemfigoid har sällan rapporterats hos patienter som fick tamoxifen.
Hudförändringar har skett hos patienter som fick tamoxifen som adjuvansbehandling för bröstcancer
Allvarliga, livshotande eller dödliga händelser förknippade med tamoxifen som används för att minska förekomsten av bröstcancer (i.
Sjukvårdsleverantörer bör diskutera potentiella fördelar kontra risker med tamoxifenbehandling med kvinnor som överväger användning av läkemedlet för att potentiellt minska risken för att utveckla bröstcancer
På grund av den ökade risken för tromboemboliska händelser förknippade med tamoxifenbehandling i BCPT, är tamoxifen för minskning av förekomsten av bröstcancer kontraindicerat hos kvinnor med en historia av djupvenetrombos eller lungemboli.
Användning av tamoxifen för att minska förekomsten av bröstcancer är också kontraindicerat hos kvinnor som behöver antikoagulantia med ett kumarinderivat.
Kvinnor som får eller som har fått tamoxifen bör omedelbart söka läkare för symptom på oförklarlig andnöd eller svullnad / ömhet i benen
Användning av tamoxifen är förknippat med en ökad förekomst av maligniteter i livmodern.
Kvinnor som får tamoxifen eller kvinnor med en historia av att ha fått tamoxifen som rapporterar onormal vaginal blödning bör utvärderas omgående.
Kvinnor som får eller som har fått tamoxifen bör få rutinmässig gynekologisk vård och bör uppmanas att omedelbart rapportera alla onormala gynekologiska symtom, såsom menstruations oregelbundenheter, onormal vaginal blödning, förändring i vaginal urladdning eller bäcken smärta / tryck till deras läkare
Kvinnor som får eller som har fått tamoxifen bör också kontakta läkare omedelbart efter nya bröstklumpar.
Kvinnor bör informera alla vårdgivare, oavsett orsak till utvärdering, att de får tamoxifenbehandling
Tillverkaren uppger att tamoxifen bör användas med försiktighet hos patienter med leukopeni och trombocytopeni, och periodiska fullständiga blodantal, inklusive trombocytantal, bör utföras hos patienter som får läkemedlet.
Tillverkaren uppger också att periodiska leverfunktionstester bör erhållas
På grund av sällsynta rapporter om lipoproteinavvikelser hos patienter som får tamoxifen, inklusive fall av hypertriglyceridemi, markerad hyperlipoproteinemi, rekommenderas periodisk övervakning av serum triglycerider och kolesterol under tamoxifenbehandling hos patienter med en tidigare existerande hyperlipoproteinemi
Kvinnor som är gravida eller som planerar att bli gravida bör inte använda tamoxifen för att minska risken för bröstcancer
Tamoxifen är kontraindicerat hos patienter med känd överkänslighet mot läkemedlet
I BCPT var 16% av deltagarna i studien 65 år eller äldre och 6% var minst 70 år.
Minskningar i förekomsten av bröstcancer observerades hos kvinnor som fick tamoxifen i alla åldersgrupper.
I alla andra resultat återspeglar resultaten i delmängden av kvinnor 65 år eller äldre de resultat som observerades i delmängden av kvinnor minst 50 år.
I denna studie är risken för allvarliga biverkningar (t.ex.
För sexuellt aktiva kvinnor i fertil ålder som får tamoxifen för att minska förekomsten av bröstcancer bör behandling med läkemedlet initieras under menstruationen.
Hos kvinnor med menstruations oregelbundenhet bör graviditetstestning med negativ beta-HCG bekräftas omedelbart före inledningen av tamoxifenbehandling.
Det är inte känt om tamoxifen fördelas i mjölk.
På grund av potentialen för allvarliga biverkningar av tamoxifen hos ammande barn, bör ett beslut fattas om att avbryta ammande eller läkemedlet, med hänsyn till läkemedlets betydelse för kvinnan.
FDA-graviditetsrisk kategori D: / POSITIV BEVISNING AV RISK.
Studier på människor eller undersöknings- eller postmarknadsföringsdata har visat fosterrisk.
Ändå kan potentiella fördelar med användningen av läkemedlet uppväga den potentiella risken.
Till exempel kan läkemedlet vara acceptabelt om det behövs i en livshotande situation eller allvarlig sjukdom för vilka säkrare läkemedel inte kan användas eller är ineffektiva
Den aktuella studien har prospektivt undersökt förekomsten och förloppet av okulär toxicitet efter lågdos tamoxifenbehandling.
64 patienter med cancer som kunde undersökas analyserades.
Tamoxifen administrerades i en 20 mg daglig dos.
Median behandlingstid var 25 månader.
Median total tamoxifendos var 14.
Fyra patienter hade retinopati och / eller keratopati 10, 27, 31 respektive 35 månader efter initiering av tamoxifen (en förekomst av 6.
Oftalmologiska fynd bestod av minskad synskärpa, bilateralt makulärt ödem, gul-vita prickar i paramacular och fovea-områden hos alla patienter samt korneala opacitet hos en patient.
Efter uttag av tamoxifen visade sig nästan alla okulära avvikelser vara reversibla, med undantag för näthinnens opacitet.
Detta är den första prospektiva studien i litteraturen som indikerar att även konventionell lågdos tamoxifenbehandling kan inducera okulär toxicitet
Författarna / syftet var att undersöka frekvensen av ovariecyster hos tamoxifen-behandlade bröstcancerpatienter.
I studiepopulationen ingick 95 på varandra följande tamoxifenbehandlade premenopausala och postmenopausala kvinnor med bröstcancer som följdes upp av polikliniken vid Hadassah University Hospital mellan september 1990 och juni 1992.
Tamoxifen administrerades oralt (20 mg / dag).
Alla patienter genomgick en bäckenundersökning och vaginal ultrasonografi med en 5 MHz vaginal sond.
Under studien hade 11 av 95 tamoxifen-behandlade bröstcancerpatienter (11%) cyster på äggstockarna.
Fem cystor upptäcktes hos postmenopausala kvinnor (6.
Hos postmenopausala och premenopausala kvinnor var det genomsnittliga behandlingsintervallet för tamoxifen 19.
Hos 8 av de 11 patienterna försvann cystisk äggstocksförstoring efter avslutad behandling med tamoxifen.
Två patienter genomgick laparotomi på grund av ihållande cyster och den tredje på grund av ett snabbt växande myom.
De tre cysterna visade sig vara godartade.
Cystor i äggstockarna är en vanlig biverkning av tamoxifenbehandling.
Cystor i äggstockarna kan utvecklas hos tamoxifen-behandlade premenopausala och postmenopausala kvinnor med bröstcancer.
De flesta av de tamoxifen-associerade cysterna försvinner efter att tamoxifen-behandlingen har övergivits
En patient som fick tamoxifen som adjuvansbehandling för bröstcancer utvecklade mycket allvarlig hypertriglyceridemi, hyperkolesterolemi och akut pankreatit efter att ha behandlats i 4 månader.
Hyperlipidemi korrigerades efter upphörande av tamoxifen och inrättandet av gemfibrozil-behandling.
Denna patient tycks ha typ IV-hyperlipidemi.
Hos sådana patienter föreslås att tamoxifen bör användas med stor försiktighet eftersom den svagt östrogena effekten av detta medel kan orsaka allvarlig och livshotande hyperlipidemi
Kvinnor med bröstcancer som behandlades med tamoxifen hade 82% ökad risk för ischemisk stroke och 29% ökad risk för stroke, men den absoluta risken är liten
interaktioner:
Samtidig användning av Aminoglutetimid kan minska plasmakoncentrationerna av tamoxifen och N-desmetyltamoxifen
Samtidig användning av kumarinderivativa antikoagulantia kan leda till en signifikant ökning av antikoaguleringseffekten.
DCIS)
Samtidig användning av bromokriptin kan öka serumnivåerna av tamoxifen och N-desmetyltamoxifen
Samtidig användning av cytotoxiska medel kan leda till ökad risk för tromboemboliska händelser
Samtidig användning av letrozol kan minska plasmakoncentrationerna av letrozol
Samtidig användning av medroxyprogesteron kan leda till minskade plasmakoncentrationer av N-desmetyltamoxifen
Samtidig användning av fenobarbital eller rifampin kan minska plasmakoncentrationerna av tamoxifen
Överdriven antikoagulering som tillskrivs en interaktion mellan tamoxifen och warfarin rapporteras hos 6 patienter med neoplasma med tromboembolisk sjukdom.
En patient utvecklade ett subduralt hematom och en annan hematuri.
I den första patienten drogs warfarin ut och i den andra ersattes fenindion.
Hos de återstående patienterna återförde reduktion av dosen warfarin protrombintider till terapeutiska värden.
En möjlig mekanism för interaktionen diskuterades också
Den cytotoxiska effekten av en kombination av interferoner (typ I och II) och tumörnekrosfaktor, med ett antestrogeniskt läkemedel, tamoxifen, undersöktes i den östrogenreceptorpositiva humana bröstcarcinomcellinjen, MCF-7.
Cytotoxicitet mättes med MTT-analysen.
I ett försök att definiera den molekylära basen för interaktionen mellan interferonerna och tumörnekrosfaktorn eller någon av cytokinerna med tamoxifen, var induktionsegenskaperna för ett antal interferon-inducerade mRNA som svar på interferoner, tumornekrosfaktor och tamoxifen studeras.
Vi observerade en förstärkning av den cytotoxiska effekten av tumörnekrosfaktor när den kombinerades med tamoxifen.
Det verkar finnas en överlappning i signalmekanismer för interferoner och tumörnekrosfaktor eftersom två av de interferoninducerbara generna, 1-8 och 6-16 också induceras av tumörnekrosfaktor.
RNA 1-8 inducerades av både interferon-alfa (typ I) och interferon-gamma (typ II).
Vi drar slutsatsen att tumörnekrosfaktor förstärker de cytotoxiska effekterna av tamoxifen i MCF-7-celler och att de tre cytokinerna interferon-alfa, interferon-gamma och tumörnekrosfaktor delar vissa vägar som leder till specifik induktion av vissa cytokinresponsiva gener.
En ny kombination av två läkemedel av tamoxifen och rifampicin har undersökts för behandling av gallvägsassocierade maligniteter.
Deras effekter, ensamma och i kombination, på humana tumörceller studerades med användning av två pancreaskarcinomcellinjer.
MIA PaCa-2 och AsPC-1, och en gallblåsarkarcinomcellinje, G-415.
Hämning av tillväxt användes som slutpunkt.
Cellerna skilde sig åt i känslighet för ekvimolära doser av de två läkemedlen som gavs som enskilda medel.
Kombinerade doser av rifampicin och tamoxifen resulterade i tillväxtinhibering i en utsträckning som tyder på tillsatseffekter eller synergistiska läkemedelseffekter.
Mer detaljerad analys genomfördes, inbegripet produktionen av ett ”hölje av additivitet” för varje cellinje.
En tillsatseffekt av läkemedelskombinationen visade sig inträffa i alla tre cellinjerna, vilket tillhandahöll en grund för användning av denna nya två läkemedelskombination vid behandling av gallvägsassocierade maligniteter.
Tamoxifen, en selektiv östrogenreceptormodulator (SERM), omvandlas till 4-hydroxitamoxifen och andra aktiva metaboliter med cytokrom P450 (CYP) enzymer.
Selektiva serotoninåterupptagshämmare (SSRI), som ofta föreskrivs för att lindra tamoxifenassocierade värmevallningar, kan hämma CYP.
I en prospektiv klinisk prövning testade vi effekterna av samtidig administrering av tamoxifen och SSRI-paroxetin, en hämmare av CYP2D6, på tamoxifenmetabolismen.
Tamoxifen och dess metaboliter mättes i plasma hos 12 kvinnor av känd CYP2D6-genotyp med bröstcancer som tog adjuvans tamoxifen före och efter 4 veckors samadministrerad paroxetin.
Undersökare / bedömde den hämmande aktiviteten för rena tamoxifenmetaboliter i en östradiolstimulerad MCF7-cellproliferationsanalys.
För att bestämma vilka CYP-isoformer som var involverade i metabolismen av tamoxifen till specifika metaboliter, användes CYP-isoformspecifika hämmare /.
Alla statistiska test var dubbelsidiga.
Författarna / separerade, renade och identifierade metaboliten 4-hydroxi-N-desmetyl-tamoxifen, som vi gav namnet endoxifen.
Plasmakoncentrationerna av endoxifen minskade statistiskt signifikant från ett medelvärde på 12.
L innan paroxetin samtidigt administreras till 5.
L efteråt (skillnad = 6.
L, 95% konfidensintervall [Cl] = 2.
L) (P =.
Endoxifenkoncentrationer minskade med 64% (95% CI = 39% till 89%) hos kvinnor med en vildtyp CYP2D6-genotyp men endast med 24% (95% CI = 23% till 71%) hos kvinnor med en variant CYP2D6-genotyp ( P =.
Endoxifen och 4-hydroxitamoxifen inhiberade östradiolstimulerad MCF7-cellproliferation med lika stor kraft.
In vitro inhiberade troleandomycin, en hämmare av CYP3A4, demetyleringen av tamoxifen till N-desmetyl-tamoxifen med 78% (95% CI = 65% till 91%), och kinidin, en hämmare av CYP2D6, reducerade den efterföljande hydroxyleringen av N -desmetyl-tamoxifen till endoxifen med 79% (95% Cl = 50% till 108%).
Endoxifen är en aktiv tamoxifenmetabolit som genereras via CYP3A4-medierad N-demetylering och CYP2D6-medierad hydroxylering.
Samtidig administrering av paroxetin minskade plasmakoncentrationen av endoxifen.
Våra data antyder att CYP2D6-genotyp och läkemedelsinteraktioner bör övervägas hos kvinnor som behandlas med tamoxifen
Tamoxifen, en selektiv östrogenreceptormodulator (SERM), omvandlas till 4-hydroxitamoxifen och andra aktiva metaboliter med cytokrom P450 (CYP) enzymer.
Selektiva serotoninåterupptagshämmare (SSRI), som ofta föreskrivs för att lindra tamoxifenassocierade värmevallningar, kan hämma CYP.
I en prospektiv klinisk prövning testade vi effekterna av samtidig administrering av tamoxifen och SSRI-paroxetin, en hämmare av CYP2D6, på tamoxifenmetabolismen.
Författarna / separerade, renade och identifierade metabolitten 4-hydroxi-N-desmetyl-tamoxifen, som / var / namngav endoxifen.
Plasmakoncentrationerna av endoxifen minskade statistiskt signifikant från ett medelvärde på 12.
Endoxifen är en aktiv tamoxifenmetabolit som genereras via CYP3A4-medierad N-demetylering och CYP2D6-medierad hydroxylering.
Samtidig administrering av paroxetin minskade plasmakoncentrationen av endoxifen.
Våra data antyder att CYP2D6-genotyp och läkemedelsinteraktioner bör övervägas hos kvinnor som behandlas med tamoxifen
Miljöskydd och exponering:
Miljövattenkoncentrationer:
Medan data specifika för tamoxifen inte lokaliserades (SRC, 2006) tyder litteraturen på att vissa farmaceutiskt aktiva föreningar som härrör från human- och veterinärterapi inte elimineras fullständigt i kommunala avloppsreningsverk och därför släpps ut i mottagande vatten (1).
Avloppsreningsprocesser utformades ofta inte för att ta bort dem från avloppsvattnet (2).
Valda organiska avfallsföreningar kan vara nedbrytande till nya och mer beständiga föreningar som kan frisättas i stället för eller utöver moderföreningen (2).
Studier har visat att flera polära farmaceutiskt aktiva föreningar kan läcka genom undergrunder (1)
Mjölkkoncentrationer:
EXPERIMENTAL: Det är inte känt om tamoxifen fördelas i mjölk
Miljöstandarder och förordningar:
FDA-krav:
Listan över godkända läkemedel med terapeutiska ekvivalensvärderingar identifierar för närvarande marknadsförda receptbelagda läkemedelsprodukter, inklusive FDA enligt avsnitt 505 i Federal Food, Drug and Cosmetic Act
Kemiska / fysikaliska egenskaper:
Molekylär formel:
C26-H29-NO
Färg / form:
Kristaller från petroleumeter
Dissociation Constants:
Ka = 8
Oktanol / vattenfördelningskoefficient:
Var och en = 6
lösligheter:
I vatten, 16.
L vid 25 grader C (öst)
Ångtryck:
X10-8 mm Hg vid 25 ° C (est)
Skyddsutrustning och kläder:
Skyddskläder: Engångsklänningar med slutna framdelar eller overaller, engångshandskarhandskar över engångslatexhandskar, NIOSH-godkänd luftrenande halvmaskeringsapparat som är utrustad med ett högeffektivt filter och ögonskydd bör bäras.
Arbetsstationer i ren luft 100, både horisontellt och vertikalt luftflöde (utan inneslutningskaraktäristik), är olämpliga tekniska kontroller för hantering av farliga läkemedel eftersom de inte ger något personalskydd och tillåter miljöföroreningar.
Även om det inte finns några tekniska kontroller utformade specifikt för säker hantering av farliga kemikalier som sterila produkter, har klass II innehållande vertikala flöden biologiska säkerhetsskåp (biohazard-skåp) har använts för denna användning.
Biohazard-skåp är dock utformat för hantering av smittämnen, inte farliga kemikalier.
Baserat på design, användarvänlighet och kostnadsöverväganden rekommenderas för närvarande klass II-vertikalt flöde av biohazard-skåp för användning vid beredning av sterila doser av farliga läkemedel.
Klass II skåpdesign och prestandaspecifikationer definieras i NSF Standard 49.
Biologiska säkerhetsskåp valda för användning med farliga läkemedel bör uppfylla NSF Standard 49 specifikationer för att säkerställa maximalt skydd från dessa tekniska kontroller.
Arbetare bör bära pulverfria, engångs kirurgiska latexhandskar av god kvalitet vid framställning av farliga läkemedel.
Urvalskriterier för handskar bör innehålla tjocklek (särskilt vid fingertopparna där spänningen är störst), passform, längd och taktil känsla.
Utövandet av dubbelhandskar stöds av forskning som indikerar att många handskmaterial varierar i läkemedelspermeabilitet även inom partier.
I allmänhet passar kirurgiska latexhandskar bättre, har lämplig elasticitet för dubbelhandskar och upprätthåller integriteten hos handskar-klänningsgränssnittet och har tillräcklig taktil känsla (även under dubbelhandskar) för stränga aseptiska procedurer.
Pulverhandskar bör undvikas.
Arbetare som inte skyddas av inneslutningen i ett biohazard-skåp bör använda andningsskydd vid hantering av farliga läkemedel.
Andningsskydd bör vara ett komplement till och inte ersätta teknisk kontroll.
Kirurgiska masker av alla slag ger inget andningsskydd mot pulveriserade eller flytande aerosoler av farliga läkemedel.
I situationer där arbetare kan utsättas för potentiell ögonkontakt med farliga läkemedel, bör en lämplig ansiktsskydd av plast eller stänkskyddsglasögon bäras.
Under sammansättning av farliga läkemedel (t.ex. krossning, upplösning och beredning av en salva) bör arbetarna bära klänningar med låg permeabilitet och dubbla handskar.
Förening bör ske i ett skyddande område som en engångshandskar.
Om sammansättning måste göras utomhus måste ett område borta från drag och trafik väljas, och arbetaren ska använda lämpligt andningsskydd.
Förebyggande åtgärder:
Oavsiktlig kontaminering av vårdmiljön, vilket resulterar i exponering av personal, patienter, besökare och familjemedlemmar för farliga ämnen, förhindras genom att bibehålla den fysiska integriteten och säkerheten för paket med farliga läkemedel.
Tillgång till alla områden där farliga läkemedel lagras är begränsad till specificerad behörig personal.
En metod bör finnas för att identifiera läkemedel som kräver särskilda försiktighetsåtgärder (t.ex. cytotoxika) för personal.
Ett sätt att uppnå detta är att applicera lämpliga varningsetiketter på alla farliga läkemedelsbehållare, hyllor och fack där läkemedelsprodukterna lagras.
En metod för att identifiera, för patienter och familjemedlemmar, de läkemedel som kräver särskilda försiktighetsåtgärder i hemmet bör finnas på plats.
Detta kan åstadkommas inom miljövården genom att tillhandahålla specifik märkning för utskrivningsmedicinering tillsammans med skriftliga instruktioner.
Metoder för att identifiera fraktkartonger med farliga läkemedel bör krävas från tillverkare och distributörer av dessa läkemedel.
Skriftliga förfaranden för hantering av skadade paket med farliga läkemedel bör bibehållas.
Personal som är involverade i frakt och mottagande av farliga läkemedel bör utbildas i dessa procedurer, inklusive korrekt användning av skyddskläder och utrustning.
Skadade fraktkartonger med farliga läkemedel ska tas emot och öppnas i ett isolerat område (t.ex. i en laboratorieågor, om sådan finns, inte i ett vertikalt laminärt luftflöde biologiskt säkerhetsskåp som används för beredning av sterila produkter).
Anläggningar (t.ex. hyllor, vagnar, diskar och brickor) för lagring av farliga läkemedel är utformade för att förhindra brott och för att begränsa föroreningar i händelse av läckage.
Fack, hyllor med spärrar framtill eller andra designfunktioner som minskar risken för att läkemedelsbehållare faller på golvet bör användas.
Farliga läkemedel som kräver kylning bör förvaras separat från icke-farliga läkemedel i enskilda fack som är utformade för att förhindra brott och att innehålla läckage.
Fram tills reproduktionsriskerna (eller bristen på sådana) som är förknippade med hantering av farliga läkemedel inom ett säkerhetsprogram har bekräftats, bör personal som är gravida eller ammar kunna undvika kontakt med dessa läkemedel.
Politik bör vara i kraft som ger dessa individer alternativa uppgifter eller ansvar om de så önskar.
Apoteket bör ge tillgång till information om toxicitet, behandling av akut exponering (om tillgänglig), kemiska inaktiveringsmedel, löslighet och stabilitet för farliga läkemedel (inklusive utredningsmedel) som används på arbetsplatsen.
Lämpliga tekniska kontroller bör finnas för att skydda läkemedelsprodukten från mikrobiell kontaminering och för att skydda personal och miljö från produktens potentiella risker.
Dessa tekniska kontroller bör upprätthållas enligt gällande regler och standarder.
Biologiska säkerhetsskåp bör rengöras och desinficeras regelbundet för att säkerställa en lämplig miljö för beredning av sterila produkter.
Vid rutinmässig rengöring av ytor mellan sanering ska vatten användas (för injektion eller bevattning) med eller utan en liten mängd rengöringsmedel.
Om föroreningen endast är löslig i alkohol kan 70% isopropyl eller etylalkohol användas utöver rengöringsmedlet.
I allmänhet är alkohol inte ett bra rengöringsmedel, bara ett desinfektionsmedel och användningen i ett biohazard-skåp bör begränsas.
Biohazard-skåpet ska desinficeras med 70% alkohol innan någon aseptisk manipulation påbörjas.
Överdriven användning av alkohol bör undvikas i biohazard-skåp där luft återcirkuleras.
Ett luddfritt engångsfoder med plaststöd kan användas i det biologiska säkerhetsskåpet för att underlätta rengöring av spill.
Om det används bör fodret bytas ofta.
De biologiska säkerhetsskåpen ska dekontamineras regelbundet (helst minst en gång i veckan) och närhelst utsläpp eller det biologiska säkerhetsskåpet flyttas eller servas, inklusive för certifiering.
För närvarande kommer inget enda reagens att avaktivera alla kända farliga läkemedel.
Det valda rengöringsmedlet bör ha ett pH som är ungefär det som tvål och är lämpligt för rostfritt stål.
Rengöringsmedel som innehåller kemikalier som kvaternära ammoniumföreningar bör användas med försiktighet eftersom de kan vara farliga för människor och deras ångor kan byggas upp i alla biologiska säkerhetsskåp där luft återcirkuleras.
Liknande försiktighet bör användas med alla aerosolrengöringsmedel under tryck.
Under dekontaminering bör operatören bära en stängd främre klänning, engångslatexhandskar täckta av engångshandskar, skyddsglasögon eller skyddsglasögon, en hårbeläggning och en engångsapparat, eftersom glasskyddet i det biologiska säkerhetsskåpet ibland måste lyftas.
Fläkten måste stå kvar och endast tung handduk eller gasbindning ska användas i det biologiska säkerhetsskåpet för att förhindra att den ”sugs” upp i kammaren och i det högeffektiva partikelfilteret.
Dekontaminering bör utföras från topp till botten (områden med mindre föroreningar till större) genom att applicera rengöringsmedlet, skrubba och skölja noggrant med destillerat eller avjoniserat vatten.
De högeffektiva partikelformiga luftfiltren / eller annat avgassystem / i biohazard-skåpet måste bytas ut när de begränsar den erforderliga luftflödeshastigheten eller om de är förorenade (t ex genom ett brott i teknik som gör att farligt läkemedel införs i rena sidan av tillförseln partikelfilter med hög effektivitet).
Personal- och miljöskydd måste upprätthållas vid byte av ett förorenat partikelfilter med hög effektivitet.
Eftersom ersättning av ett partikelformigt luftfilter med hög effektivitet i allmänhet kräver att integriteten hos skåpets inneslutning bryts, kan denna procedur frigöra föroreningar från filtret i apoteket eller det intravenösa beredningsområdet om det utförs på ett olämpligt sätt.
Innan ett partikelfilter med hög effektivitet som är förorenat med farliga läkemedel byts ut, bör servicemedlet för biologisk säkerhetsskåp konsulteras för en ömsesidigt godtagbar procedur för att byta ut och sedan bortskaffa ett förorenat partikelfilter med hög effektivitet.
En procedur skulle innefatta att flytta det biologiska säkerhetsskåpet till ett avskilt område eller använda plastbarriärer för att separera det förorenade området.
Skyddskläder och utrustning måste användas av servicen.
Det biologiska säkerhetsskåpet ska dekontamineras före filterbyte.
Under avlägsnande av handskar,.
Arbetaren ska bära en skyddande engångsklänning tillverkad av luddfri, låg permeabilitetstyg med en solid front, långa ärmar och tätt passande elastiska eller stickade manschetter när han förbereder farliga droger.
Tvättbara plagg penetreras omedelbart av vätskor och ger därför lite, om något skydd.
Vid dubbelhandskar ska en handske placeras under klänningskanten och en över.
Handskar-klänningsgränssnittet ska vara sådant att ingen hud på armen eller handleden utsätts.
Handskar och klänningar ska inte bäras utanför området för omedelbar beredning.
Ögonmaskfontener bör finnas tillgängliga i områden där farliga läkemedel rutinmässigt hanteras.
Även om icke-injicerbara doseringsformer av farliga läkemedel innehåller varierande andelar av läkemedel till icke-läkemedelskomponenter (icke-farliga) komponenter, finns det potential för personalexponering och miljökontaminering med de farliga komponenterna.
Förfaranden bör utvecklas för att undvika frisättning av aerosoliserat pulver eller vätska i miljön under manipulation av dessa läkemedel.
Läkemedel som anges som farliga ska märkas eller på annat sätt identifieras som sådana för att förhindra att de hanteras felaktigt.
Tabletter och kapselformer av dessa läkemedel bör inte placeras i automatiska räknemaskiner, som utsätter dem för stress och kan införa pulveriserade föroreningar i arbetsområdet.
Under rutinmässig hantering av farliga läkemedel och förorenad utrustning bör arbetarna bära ett par handskar av god kvalitet och tjocklek.
Räkning och hälla av farliga läkemedel bör göras noggrant och ren utrustning avsedd för användning med dessa läkemedel bör användas.
När farliga läkemedelstabletter i förpackning för användning krossas ska förpackningen placeras i en liten plastbar påse som kan tätas och krossas med en sked eller en stöt.
Avfallshantering av oanvända eller oanvändbara orala eller lokala dosformer av farliga läkemedel bör utföras på samma sätt som för farliga injicerbara doseringsformer och avfall.
Arbetsområden med farliga läkemedel bör ha ett diskbänk (helst med en ögonsköljningsbrunn) och lämplig första hjälpenutrustning för att behandla oavsiktlig hud- eller ögonkontakt enligt protokollet.
En distinkt varningsetikett med lämpligt FÖRSIKTIGHETsförklaring bör bifogas alla farliga läkemedelsmaterial, i överensstämmelse med statliga lagar och förordningar.
Detta skulle till exempel inkludera sprutor, IV-behållare, behållare med enhetsdosta tabletter och vätskor, receptflaskor och flaskor, avfallsbehållare och patientprover som innehåller farliga läkemedel.
Tillförsel av engångshandskar och klänningar, skyddsglasögon, engångsabsorberade plastfoder, gasbindelar, kassar för farligt avfall, varningsetiketter för farliga läkemedel och punkteringsbeständiga behållare för bortskaffande av nålar och ampuller bör vara beläget på alla områden där farliga avfall droger hanteras.
Att sätta ihop ett ”farligt läkemedelsberedning och administreringssats” är ett sätt att förse sjuksköterska och medicinsk personal med de material som behövs för att minska risken för beredning och administrering av ett farligt läkemedel.
Framtida tillfälliga och permanenta anställda som kan krävas att arbeta med farliga läkemedel bör meddelas så och de ska få tillräcklig information om policys och rutiner för deras användning.
Denna anmälan ska dokumenteras under intervjuprocessen och behållas som en del av anställningsregistret för alla anställda.
All personal som är involverad i transport, beredning, administration och bortskaffande av cytotoxiska och farliga ämnen bör kontinuerligt uppdateras med ny eller reviderad information om säker hantering av cytotoxiska och farliga ämnen.
Politik och förfaranden bör uppdateras i enlighet med detta.
Arbetsområdet bör utformas så att det blir lätt tillgång till de artiklar som är nödvändiga för att förbereda, märka och transportera slutprodukter.
Varje hälso- och sjukvårdssituation bör ha ett etablerat protokoll för första hjälpen för att behandla fall av direktkontakt med farliga läkemedel, av vilka många är irriterande eller kaustiska och kan orsaka vävnadsnedbrytning.
Medicinska vårdgivare i varje inställning ska kontaktas för inmatning i detta protokoll.
Protokollet bör omfatta omedelbara behandlingsåtgärder och ska ange typ och plats för medicinsk uppföljning och rapportering av arbetsskador.
Kopior av protokollet, som framhäver nödåtgärder, bör publiceras varhelst farliga läkemedel rutinmässigt hanteras.
Endast personer som är utbildade för att administrera farliga läkemedel bör tillåtas utföra denna funktion.
Utbildningsprogram bör innehålla information om de terapeutiska och negativa effekterna av dessa läkemedel och den potentiella, långsiktiga hälsorisken för personal som hanterar dessa läkemedel.
Varje individs kunskap och teknik bör utvärderas innan dessa läkemedel administreras.
Detta bör göras genom skriftlig granskning och direkt observation av individens prestationer.
Fraktmetoder och föreskrifter:
Metoder för att transportera farliga läkemedel till hälso- och sjukvården bör överensstämma med miljöskydd och nationella eller lokala bestämmelser för transport av farliga ämnen.
När farliga läkemedel transporteras till hemvården bör lämpliga behållare (t.ex. fodrade kartonger) och procedurer användas för att förhindra brott och innehålla läckage.
Läkemedlen måste vara ordentligt täckta eller förslutna och förpackas och skyddas korrekt under transport för att ytterligare minska risken för brott och spill i ett offentligt område som en korridor eller hiss.
Lagringsförhållanden:
Kommersiellt tillgängliga tamoxifen-tabletter ska skyddas mot ljus och förvaras i väl stängda behållare vid kontrollerad rumstemperatur (20-25 ° C)
Rensningsmetoder:
Spillsatser som innehåller allt material som behövs för att rensa upp spill av farliga läkemedel bör monteras eller köpas.
Dessa satser bör vara tillgängliga i alla områden där farliga läkemedel rutinmässigt hanteras.
Om farliga läkemedel förbereds eller administreras i ett icke-routint område (heminställning eller ovanligt patientvårdsområde), bör läkemedelshandlare erhålla ett utsläppssats.
Satsen bör innehålla två par engångshandskar (ett yttre par verktygshandskar och ett inre latexpar).
Alla individer som rutinmässigt hanterar farliga läkemedel måste utbildas i korrekt hantering och sanering.
Spill och sprickor måste städas omedelbart enligt följande procedurer.
Om spillet inte är beläget i ett trångt utrymme, bör spillområdet identifieras och andra personer ska förhindras från att närma sig och sprida föroreningen.
Bär skyddskläder från spillutrustningen, bör arbetarna ta bort alla trasiga glasfragment och placera dem i en punkteringsbeständig behållare.
Vätskor ska absorberas med en spilldyna.
Det farliga materialet ska tas bort helt och området sköljs med vatten och rengöras sedan med tvättmedel.
Rengöringen av spill ska ske gradvis från områden med mindre till större föroreningar.
Tvättmedlet ska sköljas noggrant och tas bort.
Allt förorenat material ska placeras i de tillhandahållna avfallspåsarna och förseglas och transporteras till en utsedd behållare.
Utsläpp som förekommer i biohazard-skåpet ska rengöras omedelbart.
Om det finns trasigt glas, bör handskar bäras för att ta bort det och placera det i den punkteringsbeständiga behållaren i biohazard-skåpet.
Det biologiska säkerhetsskåpet, inklusive avloppsvatten, bör rengöras noggrant.
Om utsläppet inte lätt och noggrant hålls in ska det biologiska säkerhetsskåpet dekontamineras efter rengöring.
Om spillet förorenar det partikelformiga luftfiltret med hög effektivitet, bör användningen av det biologiska säkerhetsskåpet avbrytas tills skåpet har dekontaminerats och det högeffektiva partikelfilteret bytts ut.
Om farliga läkemedel rutinmässigt framställs eller administreras i mattor, är specialutrustning nödvändig för att ta bort spillet.
Absorberande pulver bör ersättas med dynor eller ark och lämnas på plats på spillet under den tid som tillverkaren rekommenderar.
Pulvret ska sedan plockas upp med en liten vakuumenhet reserverad för farlig läkemedelsrening.
Matten ska sedan rengöras enligt vanliga rutiner.
Dammsugarpåsen ska tas bort och kasseras eller rengöras, och utsidan av dammsugaren ska tvättas med tvättmedel och sköljas innan den täcks och förvaras.
Det kontaminerade pulvret ska kasseras i en tätbar plastpåse och separeras med andra förorenade avfallsmaterial.
Alternativt kan billiga våta eller torra vakuumenheter köpas för denna uttryckliga användning och användas med lämpliga rengöringsmedel.
Alla sådana enheter är förorenade, när de har använts och måste rengöras, lagras och slutligen kasseras / ordentligt /.
Omständigheterna och hanteringen av spill ska dokumenteras.
Sjukvårdspersonal som exponeras under spillhantering bör också fylla i en incidentrapport eller exponeringsformulär.
Avfallshanteringsmetoder:
SRP: Vid granskningen är kriterier för landbehandling eller begravning (sanitär deponering) föremål för betydande revideringar.
Innan du genomför markförvaring av avfallsrester (inklusive avfallsslam), rådgör med miljöreglerande organ för vägledning om acceptabel avfallshantering
Alla förorenade engångsartiklar bör förvaras i förseglingsbara påsar för överföring till större avfallsbehållare.
Alla flaskor måste kasseras som förorenat avfall efter sanering av biohazard-skåpet.
All skyddskläder (klänning, handskar, skyddsglasögon och andningsskydd) ska kasseras som förorenat avfall.
De förorenade filtren måste tas bort, säckas i tjock plast och förberedas för bortskaffande på en avfallsplats för farligt avfall eller förbränningsanläggning som är licensierad av miljöskyddsverket (EPA).
Klänningen ska tas bort och placeras i en tätbar behållare innan de inre handskarna tas bort.
De inre handskarna ska tas bort sist och placeras i behållaren med klänningen.
Farligt läkemedelsavfall ska placeras i speciellt märkt (specifikt märkt FÖRSIKTIGHET: FARLIGT KEMISKT AVFALL) tjocka plastpåsar eller läcktäta behållare.
Dessa behållare bör förvaras i alla områden där läkemedlen ofta används.
Allt och endast farligt drogavfall ska placeras i dem.
Kärl som används för glasfragment, nålar och sprutor bör vara punkteringsbeständiga.
Farligt läkemedelsavfall ska inte blandas med något annat avfall.
Avfallsbehållare ska hanteras med okontaminerade handskar.
Handskar, klänningar, medicinflaskor osv. Bör förseglas i speciellt märkta (FÖRSIKTIGHET: FARLIG KEMISK AVFALL) tjocka plastpåsar eller läcktäta behållare.
Allt farligt avfall som samlas in från läkemedelsberedningar och områden för vård av patienter bör förvaras på ett säkert ställe i märkta, läcktäta trummor eller kartonger (som krävs enligt statliga eller lokala föreskrifter eller bortskaffande entreprenörer) tills bortskaffande.
Detta avfall ska bortskaffas som farligt eller giftigt avfall i en EPA-tillåten statligt licensierad förbränningsanläggning för farligt avfall.
Transport till en förbränningsanläggning på plats bör utföras av en entreprenör som har tillstånd att hantera och transportera farligt avfall.
Om tillgång till en lämpligt licenserad förbränningsanläggning inte är tillgänglig, är transport till och begravning på en EPA-licenserad dumpningsplats för farligt avfall ett acceptabelt alternativ.
Även om det finns farhågor om att förstörelse av cancerframkallande ämnen genom förbränning kan vara ofullständig, har nyare teknik och stränga licensvillkor förbättrat denna bortskaffningsmetod.
Kemisk avaktivering av farliga läkemedel bör endast utföras av individer som är välkända med kemikalierna och de förfaranden som krävs för att genomföra en sådan uppgift.
IARC publicerade nyligen en monografi som beskriver metoder för kemisk förstörelse av vissa cytotoxiska (antineoplastiska) läkemedel i laboratorieinställningen.
Kemikalierna och utrustningen som beskrivs finns dock generellt inte i den kliniska miljön, och många av de deaktiverande kemikalierna är giftiga och farliga.
De flesta förfaranden kräver användning av en kemisk rökhuv.
Förfarandena är i allmänhet svåra och inaktiveringen är inte alltid fullständig.
Man bör allvarligt överväga de negativa aspekterna av kemisk inaktivering innan man åtar sig en sådan åtgärd.
Tillsynsmyndigheter som EPA och statliga byråer för fast och farligt avfall och lokala luft- och vattenkvalitetsstyrelser måste konsulteras när det gäller klassificering och lämplig bortskaffande av läkemedel som definieras som farliga eller giftiga kemikalier.
EPA kategoriserar flera av de antineoplastiska medlen som giftigt avfall, medan många tillstånd är strängare och inkluderar som cancerframkallande ämnen vissa cytotoxiska läkemedel och hormonella preparat.
EPA tillåter också undantag från bestämmelser om giftigt avfall för generatorer med små kvantiteter, medan vissa stater inte gör det.
Det är av avgörande betydelse att undersöka dessa föreskrifter när avfallshanteringsförfaranden fastställs.
Om de biologiska säkerhetsskåpen är utrustade med en dräneringsrör och ventil kan de användas för att samla sköljvatten.
Det använda uppsamlingskärlet måste passa bra runt tömningsventilen och inte tillåta stänk.
Gas kan användas runt anslutningen för att förhindra att aerosol flyr ut.
Uppsamlingskärlet måste ha ett tätt monteringskåpa och allt sköljvatten (gas, om det används) måste kasseras som förorenat avfall.
Information om tillverkning / användning:
använder:
THERAP CAT: Antiöstrogen
MEDIKATION (Se även: Terapeutiska användningar)
tillverkare:
Siegfried (USA), Inc.
Industrial Park Rd.
Pennsville, NJ 08070, (877) 763-8630.
Produktionsplats: Pennsville, NJ 08070 / Citrate /
AstraZeneca Pharmaceuticals LP, 1800 Concord Pike, Wilmington, DE 19850-5437, (800) 236-9933 / Citrate / / Formulator /
Mylan Pharmaceuticals, Inc.
Chestnut Ridge Rd.
Morgantown, WV 26504-4310, (304) 599-2595 / Citrate / / Formulator /
Tillverkningsmetoder:
Tamoxifen syntetiseras från lämpligt substituerad desoxibensoin med en alkanolpreparat med användning av standardmetoder och en olefinisk länk genererad genom en syrakatalyserad eliminationsreaktion.
Isomerer genereras från denna process i ungefär ett 1: 1-förhållande av Z (trans) och E (cis).
Dessa isomerer kan separeras genom fraktionerad kristallisation för att ge den huvudsakliga funktionella (Z) formen av tamoxifen
Specialrapporter:
National Toxicology Program.
Elfte rapporten om cancerframkallande ämnen (2005).
Rapporten om cancerframkallande ämnen är ett informativt vetenskapligt och folkhälsodokument som identifierar och diskuterar ämnen (inklusive medel, blandningar eller exponeringsförhållanden) som kan utgöra en cancerframkallande fara för människors hälsa.
Tamoxifen (
Synonymer och identifierare:
synonymer:
Beta-dimetylaminoetoxifenyl-trans-1,2-difenylbut-1-en
Z) -2- (4- (1,2-difenyl-1-butenyl) fenoxi) fenoxi) -N, N-dimetyletanamin